
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 平衡时气体平均相对分子质量约为23.3 | |
| D. | 其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
分析 氢气来源C与水的反应,CO与水的反应,二氧化碳来源与CO与水的反应,平衡时CO为C与水反应生成CO减去CO与水反应消耗的CO,令碳与水反应生成的氢气的浓度为amol/L,则生成的CO为amol/L,令CO与水反应生成氢气的浓度为bmol/L,则生成的二氧化碳的浓度为bmol/L,消耗的CO浓度为bmol/L,结合氢气、CO浓度计算.
解答 解:令碳与水反应生成的氢气的浓度为amol/L,则生成的CO为amol/L,令CO与水反应生成氢气的浓度为bmol/L,则生成的二氧化碳的浓度为bmol/L,消耗的CO浓度为bmol/L,
平衡时氢气的浓度为1.9mol/L,则amol/L+bmol/L=1.9mol/L,
平衡时CO的浓度为0.1mol/L,则amol/L-bmol/L=0.1mol/L,
联立解得a=1,b=0.9,
A、CO在平衡时转化率=$\frac{0.9mol}{1mol}$×100%=90%,故A错误;
B、故CO2的浓度为0.9mol/L,c(H2)=1.9mol•L-1,所以c(CO2)≠c(H2),故B错误;
C、平衡时时气体为c(H2)=1.9mol•L-1,c(CO)=0.1mol•L-1,CO2的浓度为0.9mol/L,H2O(g)的起始浓度不知你计算平衡水的浓度,不能计算平均摩尔质量,故C错误;
D、其他条件不变时,缩小体积,压强增大,C(s)+H2O(g)?CO(g)+H2(g)平衡逆向进行,CO(g)+H2O(g)?CO2(g)+H2(g)平衡不动,所以H2O(g)的转化率随之降低,故D正确;
故选D.
点评 本题考查化学平衡的有关计算,难度中等,清楚反应过程是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 610 | 413 | 436 |
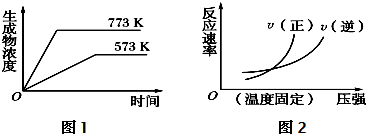
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 电极1 | 电极2 | 溶液 |
| A | Cu | Cu | 稀H2SO4 |
| B | Ag | Zn | 稀H2SO4 |
| C | Cu | Cu | 酒精 |
| D | C | C | ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
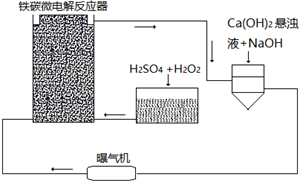
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
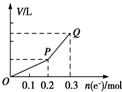 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A. | 0.1mol CuO | B. | 0.1 mol CuCO3 | ||
| C. | 0.1mol Cu(OH)2 | D. | 0.05 mol Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
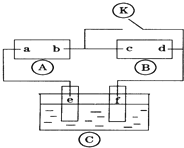 图中
图中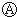 为直流电,
为直流电,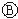 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀池.接通电路后发现
为电镀池.接通电路后发现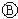 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通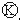 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | b为直流电的正极 | B. | e电极为铁 | ||
| C. | f极发生还原反应 | D. | d极发生的反应为:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
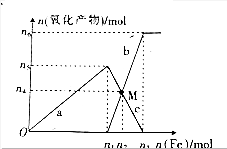 与加入铁粉的物质的量的关系如图所示.
与加入铁粉的物质的量的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com