
| A. | 碱金属元素的阳离子随核电荷数增加,氧化性渐弱而还原性渐强 | |
| B. | 碱金属元素的原子半径越大,越易失电子,其单质还原性越强 | |
| C. | 随核电荷数增多,碱金属单质的熔点一定渐低,密度一定渐大 | |
| D. | 碱金属单质的金属性强,均易与Cl2、O2、N2等发生反应 |
分析 A.碱金属元素金属性越强,其阳离子氧化性越弱;
B.碱金属元素原子半径随着原子序数增大而增大,元素的金属性越强,其单质还原性越强,其原子失电子能力越强;
C.随着核电荷数增大,碱金属单质的熔沸点较低,其密度呈增大趋势;
D.碱金属元素原子最外层只有一个电子,所以碱金属的金属性很强,其单质越易与非金属反应.
解答 解:A.碱金属元素金属性越强,其阳离子氧化性越弱,碱金属阳离子没有还原性,故A错误;
B.碱金属元素原子半径随着原子序数增大而增大,元素的金属性越强,其单质还原性越强,其原子失电子能力越强,所以碱金属元素的原子半径越大,越易失电子,其单质还原性越强,故B正确;
C.随着核电荷数增大,碱金属单质的熔沸点较低,其密度呈增大趋势,但Na密度大于K,故C错误;
D.碱金属单质的原子最外层只有1个电子,反应中容易失去电子,表现强的金属性,所以性质活泼,能够与氯气、氧气、氮气等发生反应,故D正确;
故选BD.
点评 本题考查碱金属元素周期律,为高频考点,明确同一主族原子结构、元素性质递变规律是解本题关键,注意规律中的反常现象,易错选项是C.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯食品袋耐高温加热 | |
| B. | 石英玻璃仪器耐酸碱腐蚀 | |
| C. | 羊毛织物可用强碱性洗涤剂清洗 | |
| D. | 把铅加入锡中制造焊锡的目的是降低熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
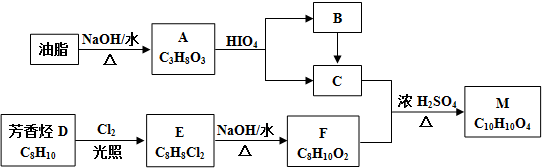
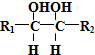 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$ 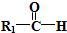 +
+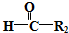
 $\stackrel{HIO_{4}}{→}$R3COOH+
$\stackrel{HIO_{4}}{→}$R3COOH+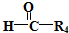
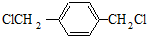 .
.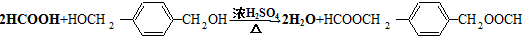 .
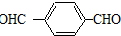
.
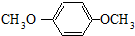
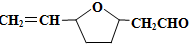
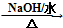 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 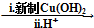 HCOOH
HCOOH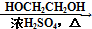 HCOOCH2CH2OOCH.
HCOOCH2CH2OOCH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
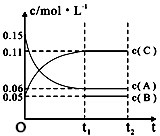
| A. | 若a=3,则b=1,c=2 | |
| B. | t1min时,该反应达到该条件下的反应限度 | |
| C. | 在O~t1min内,用C表示的化学反应速率为0.06mol•L-1 | |
| D. | B的起始浓度等于0.08mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
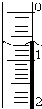 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com