
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
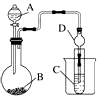 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 将二氧化硫通入到一定量氯水中 | 将氯化铝溶液滴入到一定量NaOH溶液中 | NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液 | 将铁粉加入到一 定量氯化铁溶液中 |
 | 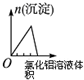 |  | 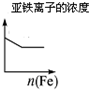 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
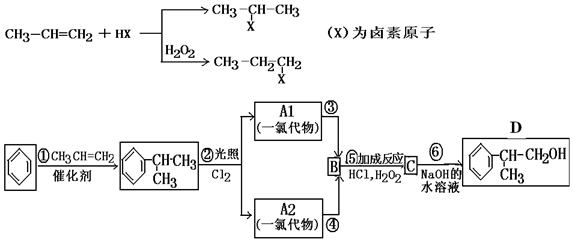
 ;
;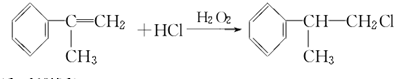 ;
;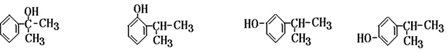 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
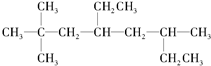 烃A的一氯代物具有不同沸点的产物有10种.
烃A的一氯代物具有不同沸点的产物有10种.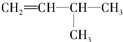 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.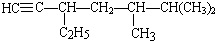 的系统名称是5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.
的系统名称是5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
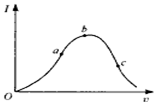 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com