
【题目】对水的电离平衡一定不产生影响的微粒是
A.![]() B.
B. C.I- D.1s22s22p63s23p6
C.I- D.1s22s22p63s23p6
【答案】C
【解析】
水的电离过程存在电离平衡,电离过程是吸热过程,酸、碱对水的电离起到抑制作用,水解的盐对水的电离起到促进作用。
A.F-核外有10个电子,离子结构示意图是![]() ,由于HF是一元弱酸,所以F-会发生水解反应,消耗水电离产生的H+,使水的电离平衡正向移动,因而会促进水的电离,A不符合题意;
,由于HF是一元弱酸,所以F-会发生水解反应,消耗水电离产生的H+,使水的电离平衡正向移动,因而会促进水的电离,A不符合题意;
B.该符号表示CH3COO-,乙酸根是弱酸阴离子,会发生水解作用,消耗水电离产生的H+,使水的电离平衡正向移动,因而会促进水的电离,B不符合题意;
C.I-是强酸阴离子,不发生水解作用,因此对水的电离无影响,C符合题意;
D.该核外电子排布式可以是阳离子或阴离子的电子排布式,因此不能确定是否影响水的电离,D不符合题意;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】用离子方程式回答下列问题:
(1)泡沫灭火器中灭火原理(内装小苏打溶液和![]() 溶液____________。
溶液____________。
(2)已知AgCl为难溶于水和酸的白色固体,![]() 为难溶于水和酸的黑色固体。向AgCl的悬浊液中加入足量的
为难溶于水和酸的黑色固体。向AgCl的悬浊液中加入足量的![]() 溶液并振荡,白色固体完全转化为黑色固体:________________。
溶液并振荡,白色固体完全转化为黑色固体:________________。
(3)③实验室配制![]() 溶液,溶解时先要加入少量的稀硫酸,其原因________;配制完毕后要加入少量铁屑,其目的是_____________。
溶液,溶解时先要加入少量的稀硫酸,其原因________;配制完毕后要加入少量铁屑,其目的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序。请你原电池原理和实验装置,完成下列实验报告。
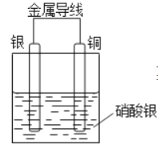
实验目的:探究Cu和Ag的金属活动性顺序
(1)电极材料:正极:_______________________ ;负极:_____________________________硝酸银溶液的作用是________________________________________________________
(2)写出电极反应式:
正极:_____________________________ ;负极:_____________________________ 。
(3)实验现象:________________________________________________________________。
(4)实验结论:________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,CO(g) + H2O (g)![]() CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
甲 | 乙 | |||
起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是
A.x = y = 0.16
B.反应开始时,乙中反应速率比甲快
C.甲中0~5min的平均反应速率: v(CO)=0.004"mol/(L·min)
D.平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途。请回答下列问题。
![]() 基态硫离子价层电子的轨道表达式为____,其电子填充的最高能级的轨道数为____。
基态硫离子价层电子的轨道表达式为____,其电子填充的最高能级的轨道数为____。
![]() 常见含硫的物质有单质硫
常见含硫的物质有单质硫![]() 、
、![]() 、
、![]() 、
、![]() 等,四种物质的熔点由高到低的顺序依次为__________。
等,四种物质的熔点由高到低的顺序依次为__________。
![]() 方铅矿
方铅矿![]() 即硫化铅
即硫化铅![]() 是一种比较常见的矿物,酸溶反应为:
是一种比较常见的矿物,酸溶反应为:![]() 浓
浓![]() ,则
,则![]() 中配位原子是__________,第一电离能
中配位原子是__________,第一电离能![]() __________
__________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,
,![]() 中硫的杂化方式为______________,下列气态分子的空间构型与
中硫的杂化方式为______________,下列气态分子的空间构型与![]() 相同的有__________。
相同的有__________。
A.SnCl2 B.SO3 ![]()
![]()
![]() 方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的__________空隙中。已知晶体密度为ρg·cm-3,阿伏加德罗常数的值为
方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的__________空隙中。已知晶体密度为ρg·cm-3,阿伏加德罗常数的值为![]() ,则晶胞中硫离子与铅离子最近的距离为__________nm。
,则晶胞中硫离子与铅离子最近的距离为__________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,密闭可变容器中发生可逆反应N2+3H2![]() 2NH3能说明反应已达到平衡状态的是
2NH3能说明反应已达到平衡状态的是
A.以上三种物质的浓度相等B.压强恒定
C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下反应中的四种物质由三种元素组成,其中a的分子空间构型为正四面体形,一个a分子含有10e-,组成b物质的元素为第3周期元素。下列判断正确的是
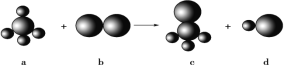
A. 四种分子中的化学键均是极性键B. a、c分子中中心原子均采用sp3杂化
C. 四种分子中既有σ键,又有π键D. b、d分子中共价键的键能:b>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO![]() 、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。25 ℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。下列说法错误的是
、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。25 ℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。下列说法错误的是

A. 25 ℃时,HClO2的电离平衡常数的数值Ka=10-6
B. 使用该漂白剂的最佳pH为3.0
C. 25 ℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO![]() )+2c(OH-)
)+2c(OH-)
D. 该温度下的NaClO2溶液中c(Na+)>c(ClO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图所示。请填写下列空白:

(1)在该溶液中含有的离子是_____________,物质的量浓度之比为_______________。
(2)所加的淡黄色固体是________________(化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com