
【题目】用CO合成甲醇的化学方程式为:CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
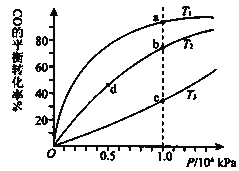
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量M(a)<M(c) M(b)>M(d)
【答案】C
【解析】
A. 反应是放热反应,同一压强下,从c点到a点,CO转化率增大,反应正向移动,说明是降温过程,因此T3>T2>T1,故A错误;
B. b、d两点的温度相同,但b点的压强大于d点,故υ(b)> υ(d),a、c两点的压强相同,根据A选项的分析得到c点的温度高,则υ(a)<υ (c),故B错误;
C. 该反应的正反应为放热反应,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,根据A选项得到T3>T2>T1,b、d温度相同,所以平衡常数相同,即K(b)=K(d);温度T3>T1,温度越高,该反应的平衡常数越小,所以K(a)>K(c),故C正确;
D. CO转化率的越大,n(总)越小,由![]() 可知,a、c点中a点n(总)小,则M(a) > M(c),b、d点中b点n(总)小,M(b)>M(d),故D错误。
可知,a、c点中a点n(总)小,则M(a) > M(c),b、d点中b点n(总)小,M(b)>M(d),故D错误。
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】某烃在标准状况下的密度为3.215 g/L,现取3.6 g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,求:
(1)该烃分子的摩尔质量。
(2)确定该烃的分子式。
(3)已知该烃的一氯代物只有一种,写出该烃的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪种说法可以证明反应N2+3H2![]() 2NH3已达到平衡状态
2NH3已达到平衡状态
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键形成的同时,有3个N—H键形成
D.1个N≡N键形成的同时,有6个N—H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一个容积为2 L的真空密闭容器中(事先装入催化剂)通入1 mol N2和3 mol H2,3 min后测得密闭容器内的压强是起始时的0.7倍,在此时间内v(H2)是
A. 0.1mol/(L·min) B. 0.2mol/(L·min)
C. 0.3mol/(L·min) D. 0.6mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为___;
H2(g)+I2(g)的平衡常数K2为___;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)C(H2)=c(CO)c(H2O),判断此时温度为___℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氢气和氧气反应生成1mol水蒸气放热241.8kJ,则反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH为( )
2H2O(g)的ΔH为( )
A.-483.6kJ·mol-1B.-241.8kJ·mol-1
C.-120.6kJ·mol-1D.+241.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注。一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
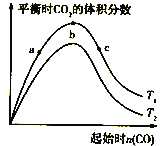
下列有关说法正确的是
A. T1比T2高 B. b点SO2转化率最高
C. b点后曲线下降是因CO体积分数升高 D. 减小压强可提高CO、SO2转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 ℃时,将1 mol H2(g)和2 mol I2(g)充入到体积为1 L的密闭容器中,发生反应:I2(g)+H2(g) ![]() 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=______,c(I2)=____,而c(HI)=____,所以化学反应速率____(填“V正”或“V逆”)最大,而_____(填“V正”或“V逆”)最小。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)___,c(I2)___,而c(HI)____,从而化学反应速率v(正)____,而v(逆)____。(均填“减小”、“增大”或“不变”。)
(3)当反应进行到v(正)与v(逆)____时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为1 L的密闭容器中发生可逆反应:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
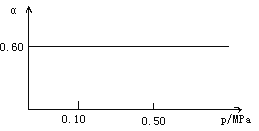
(1)写出该反应的平衡常数表达式K=__________。当反应达到平衡后,再向容器中加入铁粉和水蒸气,则K__________,(填“增大”、“减小”或“不变”,下同);升高温度,则K__________。
(2)在1 000℃时,若向上述容器中加入0.80 mol铁粉和1.00 mol水蒸气,达到平衡时,容器中c(H2)=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com