
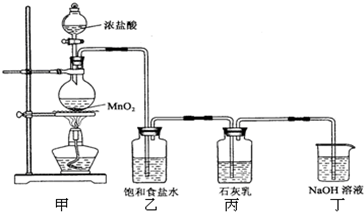
 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O; MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O; H2↑+Cl2↑+2NaOH;
H2↑+Cl2↑+2NaOH; H2↑+Cl2↑+2NaOH;
H2↑+Cl2↑+2NaOH; MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,得到定量关系:8.7g MnO2物质的量为0.1mol;
MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,得到定量关系:8.7g MnO2物质的量为0.1mol; 5CaCl2+Ca(ClO3)2+6H2O;
5CaCl2+Ca(ClO3)2+6H2O; MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,结合定量关系计算理论值;
MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,结合定量关系计算理论值; 5CaCl2+Ca(ClO3)2+6H2O;
5CaCl2+Ca(ClO3)2+6H2O;

科目:高中化学 来源: 题型:阅读理解

| 序号 | 反应 | 平衡常数 |
| ① | Au+6HNO3(浓)?Au(NO3)3+3NO2+3H2O | <<1 |
| ② | Au3++4Cl-?AuCl4- | >>1 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| n(ClO-) | n(ClO3-) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-═AuCl4- | >>1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
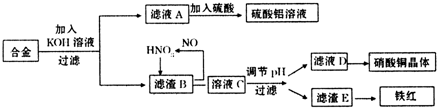


查看答案和解析>>
科目:高中化学 来源: 题型:
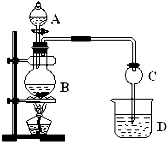 某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com