
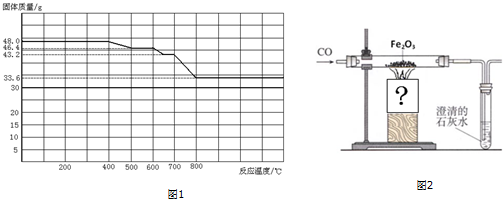
分析 (1)铁是在高温下炼制成,高温下会和空气中的氧气反应生成四氧化三铁或氧化铁,颜色都是黑色氧化物,氧化铁是红色氧化物时常温下缓慢氧化或电话腐蚀生成得到;
(2)①根据氧化:Fe2O3>Fe3O4>FeO判断与CO反应的先后顺序,然后判断反应温度500-600℃时残留固体的成分;
②根据酒精喷灯、酒精灯的温度及该反应需要的温度进行选择加热仪器;加热到质量不再变化时即为反应完全,一般两次称量的质量差小于0.1g即为反应完全;反应物CO为有毒气体,需要进行尾气处理;
(3)根据反应生成了氢氧化铁胶体和硫酸钡沉淀进行分析.
解答 解:(1)①铁是在高温下炼制成,高温下会和空气中的氧气反应生成四氧化三铁或氧化铁,颜色都是黑色氧化物,氧化铁是红色氧化物时常温下缓慢氧化或电话腐蚀生成得到;故答案为:A;
②金属铁能与稀盐酸反应放出氢气,铁离子能使KSCN溶液显血红色,故验证方法是:取少量样品加入稀盐酸,产生气泡,说明是铁,若没有产生气泡,继续滴加KSCN溶液,若溶液变血红色,说明是Fe3O4,没有变血红色说明是FeO,
故答案为:取少量样品加入稀盐酸,产生气泡,说明是铁,若没有产生气泡,继续滴加KSCN溶液,若溶液变血红色,说明是Fe3O4,没有变血红色说明是FeO;
(2)①根据氧化性Fe2O3>Fe3O4>FeO可知,与CO发生反应时,Fe2O3优先反应,然后Fe3O4反应,最后FeO反应,根据图象曲线可知,加热到400-500℃Fe2O3逐渐反应,到500℃时Fe2O3反应完全,此时固体混合物为Fe3O4、FeO,
故答案为:Fe3O4、FeO;
②精灯火焰温度为600℃左右,酒精喷灯火焰温度高于800℃,而该反应需要加热到800℃,所以只能选用酒精喷灯加热;当最后两次称量质量差小于0.1g,则氧化物全部还原为铁;由于反应中用到的还原剂CO有毒,不能直接排放,应该在排放尾气的导气管口放一盏燃着的酒精灯,将多余的CO气体通过燃烧除掉,
故答案为:酒精喷;最后两次称量质量差小于0.1g;在排放尾气的导气管口放一盏燃着的酒精灯;
(3)用稀释的FeCl3和Na2SO3溶液实验,观察到溶液颜色由黄色逐渐变为红褐色,无气泡产生,无沉淀生成,但有丁达尔现象,证明有氢氧化铁胶体生成,取红褐色液体少许,逐滴加入稀盐酸至过量,加入BaCl2溶液,有少量白色沉淀生成,证明了Fe3+与SO32-发生氧化还原反应生成SO42-,故氧化还原反应和双水解反应是同时进行的,
故答案为:两个反应均发生.
点评 本题考查了物质的检验与鉴别方法、铁及其氧化物的性质等知识,题目难度中等,注意掌握常见金属单质及其化合物性质,明确物质检验与鉴别的实验方案的设计方法.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
 (g)+CO2(g)?
(g)+CO2(g)?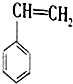 (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H| 化学键 | C-H | C-C | C=C | C=O | CO | O-H |
| 键能/kJ/mol | 413 | 348 | 615 | 745 | 1076 | 463 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
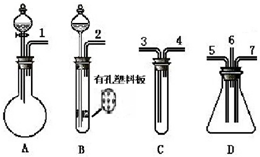 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
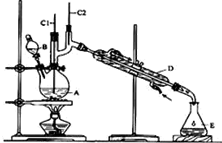 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 3:1 | C. | 1:1 | D. | 2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com