CO
2和CH
4是两种重要的温室气体,通过CH
4和CO
2反应制造更高价值化学品是目前的研究目标.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO
2、6mol CH
4,发生如下反应:CO
2(g)+CH
4(g)?2CO(g)+2H
2(g).平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=
②已知:CH
4(g)+2O
2(g)═CO
2(g)+2H
2O(g)△H=-890.3kJ?mol
-1CO(g)+H
2O(g)═CO
2(g)+H
2(g)△H=+2.8kJ?mol
-12CO(g)+O
2(g)═2CO
2(g)△H=-566.0kJ?mol
-1反应CO
2(g)+CH
4(g)?2CO(g)+2H
2(g) 的△H=
(2)以二氧化钛表面覆盖Cu
2Al
2O
4为催化剂,可以将CO
2和CH
4直接转化成乙酸.
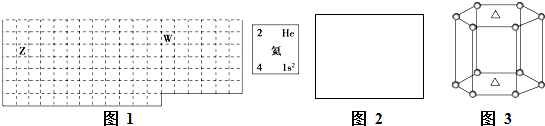
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是
②为了提高该反应中CH
4的转化率,可以采取的措施是
③将Cu
2Al
2O
4溶解在稀硝酸中的离子方程式为
(3)Li
2O、Na
2O、MgO均能吸收CO
2.①如果寻找吸收CO
2的其他物质,下列建议合理的是
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li
2O吸收CO
2后,产物用于合成Li
4SiO
4,Li
4SiO
4用于吸收、释放CO
2.原理是:在500℃,CO
2与Li
4SiO
4接触后生成Li
2CO
3;平衡后加热至700℃,反应逆向进行,放出CO
2,Li
4SiO
4再生,说明该原理的化学方程式是
(4)利用反应A可将释放的CO
2转化为具有工业利用价值的产品.反应A:CO
2+H
2O
CO+H
2+O
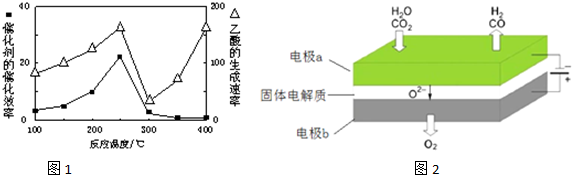
2高温电解技术能高效实现(3)中反应A,工作原理示意图如如2:CO
2在电极a放电的反应式是
.




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案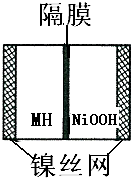 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )