
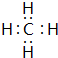 .
. 分析 X、Y、Z、W四种元素都位于元素周期表的短周期,X的原了半径为自然界中原子半径最小的,则X为H元素;W原子的最外层电子数为其电子层数的3倍,原子只能有2个电子层,最外层电子数为6,则W为O元素;原子序数X<Y<Z<W,可知Y、Z处于第二周期,X原子和Y原子最外层电子数之和与Z原子最外层电子数相等,Y与Z相邻,令Y的最外层电子数为y,则Z的最外层电子数为y+1,由W和Y原子最外层电子数之和为Z原子最外层电子数的2倍,可得6+y=2y+2,解得y=4,故Y为C元素、Z为N元素.
解答 解:(1)X、Y、Z、W四种元素都位于元素周期表的短周期,X的原了半径为自然界中原子半径最小的,则X为H元素;W原子的最外层电子数为其电子层数的3倍,原子只能有2个电子层,最外层电子数为6,则W为O元素;原子序数X<Y<Z<W,可知Y、Z处于第二周期,X原子和Y原子最外层电子数之和与Z原子最外层电子数相等,Y与Z相邻,令Y的最外层电子数为y,则Z的最外层电子数为y+1,由W和Y原子最外层电子数之和为Z原子最外层电子数的2倍,可得6+y=2y+2,解得y=4,故Y为C元素、Z为N元素,
故答案为:H;C;N;O;
(2)X与Y以4:1的个数比形成的化合物为CH4,电了式为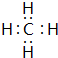 ,
,
故答案为: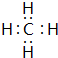 .
.
点评 本题考查结构与位置关系,难度不大,熟练掌握原子核外电子排布规律,熟练掌握元素周期律表的结构.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
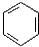 +CH3CO+HBr$\stackrel{ZnCI_{2}}{→}$
+CH3CO+HBr$\stackrel{ZnCI_{2}}{→}$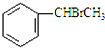 +H2O(卤烷基化反应)
+H2O(卤烷基化反应) +R′-X$\stackrel{一定条件}{→}$
+R′-X$\stackrel{一定条件}{→}$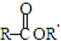 +NaX
+NaX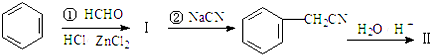 $\stackrel{NaOH}{→}$Ⅲ$\stackrel{一定条件}{→}$Ⅳ(C15H14O2)
$\stackrel{NaOH}{→}$Ⅲ$\stackrel{一定条件}{→}$Ⅳ(C15H14O2)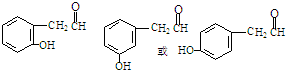 .
.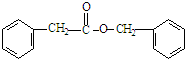 .
.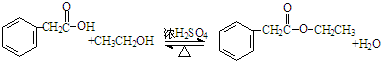 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
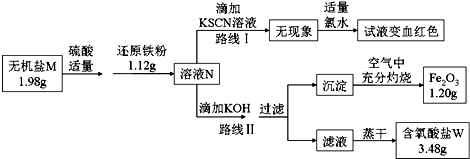
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
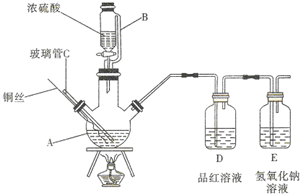 如图为某实验小组同学设计的铜与浓硫酸反应的实验装置,实验步骤如下:
如图为某实验小组同学设计的铜与浓硫酸反应的实验装置,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
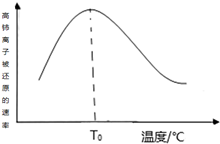 高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是高铈离子被还原的反应,正反应为放热反应,开始反应时,反应物浓度大,反应速率快,正反应为放热反应,温度逐渐升高,反应速率加快,温度高于T0℃时,反应物的浓度减少,反应速率减小,温度对反应速率的影响不及浓度的影响.
高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是高铈离子被还原的反应,正反应为放热反应,开始反应时,反应物浓度大,反应速率快,正反应为放热反应,温度逐渐升高,反应速率加快,温度高于T0℃时,反应物的浓度减少,反应速率减小,温度对反应速率的影响不及浓度的影响.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸不能盛放在玻璃试剂瓶中 | |
| B. | 由沙子制备光伏材料时的反应之一为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑ | |
| C. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 | |
| D. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
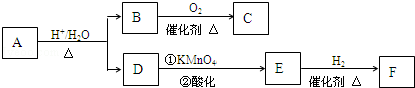
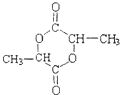 .
.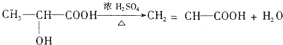 .
.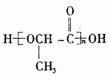 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气用氢氧化钠溶液充分吸收,反应中转移了0.5NA个电子 | |
| B. | 标准状况下分子总数为0.5 NA的H2O与CO2的总体积为11.2 L | |
| C. | 0.1 mol•L-1的NaCl溶液中含有0.1NA个Na+ | |
| D. | 2.3g钠与足量的水反应产生氢气的分子数为0.05NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com