
【题目】甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。

(1)A中铁元素发生反应的离子方程式有______________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在______(填化学符号)。
(3)资料显示:SCN--的电子式为 ![]() 。甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究:取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是___________(填名称)。
。甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究:取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是___________(填名称)。
【答案】Cl2+2Fe2+═2Cl-+2Fe3+;Fe3++3SCN-=Fe(SCN)3 Fe3+ 硫
【解析】
(1)Fe2+具有还原性,Cl2具有氧化性,发生2Fe2++Cl2=2Fe3++2Cl-,Fe3+与SCN-发生络合反应:Fe3++3SCN-=Fe(SCN)3;
答案为Cl2+2Fe2+═2Cl-+2Fe3+;Fe3++3SCN-=Fe(SCN)3;
(2)黄色溶液中加入NaOH溶液,有红褐色沉淀,该沉淀为Fe(OH)3,说明黄色溶液中含有Fe3+;
答案为Fe3+;
(3)取反应后的溶液,加入盐酸酸化的BaCl2溶液,出现白色沉淀,该沉淀为BaSO4,推出溶液中含有SO42-,而SCN-中S显-2价,说明被氧化的元素是硫元素;
答案为硫。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C原子第一至第四电离能如下: I1=738 kJ·mol-1,I2=1451 kJ·mol-1,I3=7733 kJ·mol-1,I4=10540 kJ·mol-1 |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
![]() ,该同学所画的电子排布图违背了____________。
,该同学所画的电子排布图违背了____________。
(4)G位于第_____族_____区,该元素的核外电子排布式为_____________________________。
(5)检验F元素的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家倡导推进传统产业改造升级,引导企业创新优化产业结构。其根本目的是节能减排,“减排”的关键是减少CO2排放,而“减排”的重要手段是合理利用CO2。回答下列问题:
(1)CO2的电子式是___。
(2)利用CO2可合成尿素[CO(NH2)2],合成原料除CO2外,还有NH3。该方法制备尿素的化学方程式是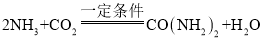 ,该方法制备尿素一般需
,该方法制备尿素一般需![]() >2,即NH3过量,原因是____。
>2,即NH3过量,原因是____。
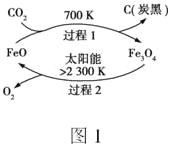
(3)利用太阳能,以CO2为原料制取炭黑的流程如图1所示:一定条件“过程1”生成1mol炭黑的反应热为ΔH1;“过程2”的热化学方程式为:2Fe3O4(s)![]() 6FeO(s)+O2(g) ΔH2。则图1中制备炭黑的热化学方程式为___。
6FeO(s)+O2(g) ΔH2。则图1中制备炭黑的热化学方程式为___。
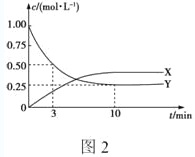
(4)将1mol CO2和3mol H2充入容积为1L的恒容密闭容器中,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。
C2H4(g)+4H2O(g) ΔH。
①图2是测得的该反应中X、Y的浓度随时间变化的曲线,其中X为___(写化学式),反应达到平衡时的平均反应速率v(H2)=____mol·L-1·min-1。
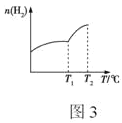
②不同温度下平衡时,混合气体中H2的物质的量随温度的变化曲线如图3所示,则该反应的ΔH____0(填“>”“<”或“不能确定”);测定温度小于T2时,反应体系中无O2存在,则T1~T2的温度范围内,H2的物质的量急剧增大的原因可能是____。
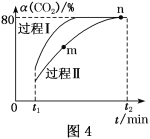
(5)CO2还可以合成甲醇:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1,一定条件下,将1 mol CO2和2.8 mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图4所示。n点的平衡常数K=___。
H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1,一定条件下,将1 mol CO2和2.8 mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图4所示。n点的平衡常数K=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是

A. 该混合气体中一定含有乙烯
B. 该混合气体一定含有甲烷和乙炔
C. 在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量为______、______、________
(2)在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为_________。
(3)一种不纯的铁,已知它含有铜、铝、镁等一种或几种金属杂质,5.6g这样的铁跟足量的稀H2SO4作用,生成H2 2.24L(标准状况),则此铁块中一定含有的金属杂质是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为 取1mol A,分别与足量的Na、NaOH、NaHCO3反应,消耗三种物质的物质的量之比为
取1mol A,分别与足量的Na、NaOH、NaHCO3反应,消耗三种物质的物质的量之比为
A. 3:3:2B. 3:2:1C. 1:1:1D. 3:4:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名或结构简式:
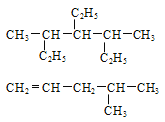
(1)_____________
(2)_____________
(3)4,4,5-三甲基-2-己炔 _______________
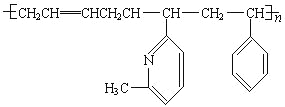
(4)新型弹性材料“丁苯吡橡胶”的结构简式如下:其单体为______________(有几种写几种)
(5)如下表所示,为提纯下列物质(括号内为少量杂质),填写所选用的除杂试剂与主要分离方法
不纯物质 | 除杂试剂 | 分离方法 | |
1 | 溴苯(Br2) | __________ | __________ |
2 | 乙醛(乙酸) | __________ | __________ |
3 | 乙酸乙酯(乙酸) | __________ | __________ |
4 | 乙醇(苯酚) | __________ | __________ |
5 | 硝基苯(硝酸) | __________ | __________ |
(6)①C5H12O的醇,在一定条件下能发生催化氧化反应,产物能与新制的氢氧化铜反应生成红色沉淀,醇的核磁共振氢谱中有三组峰,写出满足上述条件的醇的结构简式______
②C5H12O的醇,在一定条件下不能发生消去反应,写出满足条件的醇的结构简式______
③分子式为C5H12O,不能与金属钠反应.核磁共振氢谱中有四组峰,峰的面积比为3:2:1:6,写出满足上述条件的物质的结构简式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有丰富的资源,多种多样的海洋动物、植物、矿藏等。如图是从海水中提取某些物质的示意图。已知:海水中含量最高的几种离子的浓度依次为
微粒种类 | Cl- | Na+ | Mg2+ |
| Ca2+ |
微粒浓度 | 0.55mol·L-1 | 0.47mol·L-1 | 0.054mol·L-1 | 0.027mol·L-1 | 0.01mol·L-1 |
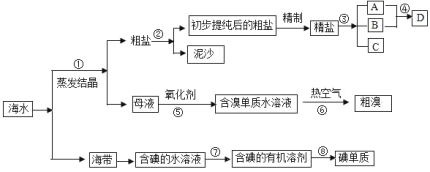
请根据以上信息回答下列问题:
(1)写出步骤②的操作名称_______;实验室中步骤⑤所需的玻璃仪器除烧杯外,还需要的仪器是___________。
(2)D具有杀菌消毒的作用,请写出反应④的离子方程式___________。
(3)初步提纯后的粗盐中含有等Ca2+、Mg2+、![]() 等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
a.加适量盐酸;b.加稍过量的氯化钡溶液,再加稍过量的NaOH溶液;c.过滤;d.蒸发结晶;e.加稍过量碳酸钠溶液
(4)____________(填“能”或“不能”)用![]() 一种试剂替代步骤②中两种试剂,理由是________。
一种试剂替代步骤②中两种试剂,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用 过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度_______________;
(2)产生的气体在标准状况下的体积_____________。(要有过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com