
【题目】一种用于驱动检验管道焊缝设备爬行器的甲醇-燃料电池的工作原理示意如图,下列有关该电池说法正确的是
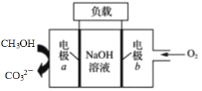
A.该电池工作时,每消耗22.4 L CH3OH转移6 mol电子
B.电子由电极a经负载流向电极b,再经过氢氧化钠溶液返回电极a,形成闭合回路
C.电池工作时,OH-向电极a移动,溶液的pH减小
D.电极b上发生的电极反应为O2+4H++4e-=2H2O
科目:高中化学 来源: 题型:
【题目】下列有关氨或铵盐的说法不正确的是
A. 可用湿润的红色石蕊试纸检验氨气
B. 用盐酸滴定氨水,当溶液呈中性时,c(NH4+) = c(Cl)
C. NH3属于弱电解质
D. 常温时,0.1 mol·L1NH4Cl溶液加水稀释,![]() 的值不变
的值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18 g·mL-1
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度c(HCl)=__ mol·L-1。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中(HCl)= ___mol·L-1。
(3)取稀释后盐酸溶液100mL,该溶液中所含的氯离子的个数为:N(Cl—)=___NA
(4)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积是___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)与氮、磷同一主族,可以形成As4、As2S3、As2O5、H3AsO3、H3AsO4等物质,有着广泛的用途。回答下列问题:
(1)As原子最外层电子的电子云伸展方向有___种。黄砷(As4)与白磷(P4)的结构类似,以下关于黄砷与白磷的比较叙述正确的是___(填编号)。
A.黄砷的熔点高于白磷 B.黄砷中共价键键能大于白磷
C.黄砷分子极性大于白磷 D.分子中共价键键角均为109°28′
(2)As元素的非金属性比N弱,用原子结构的知识说明理由。___。
(3)298K时,将20mL3xmol/LNa3AsO3、20mL3xmol/LI2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
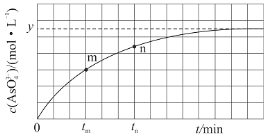
①若平衡时,pH=14,该反应的平衡常数为___。
②当反应达到平衡时,下列选项正确的是__(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.![]() 不再变化 d.c(I-)=ymol/L
不再变化 d.c(I-)=ymol/L
③tm时,v正__v逆(填“大于”“小于”或“等于”)。
④tm时,v逆__tn时v逆(填“大于”“小于”或“等于”),理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.FeCl3溶液中加入铜粉:2Fe3++3Cu=2Fe+3Cu2+
B.Al2O3溶于烧碱溶液:2Al3++3O2-+2OH-=2AlO![]() +H2O
+H2O
C.Al(OH)3溶于稀硫酸:Al(OH)3+3H+=Al3++3H2O
D.氢氧化钡溶液与硫酸溶液反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列3种有机化合物A:CH2=CH2、B:![]() 、C:CH3COOH。
、C:CH3COOH。
(1)写出化合物A、C中官能团的名称:___________、_______。
(2)3种化合物中能使溴的四氯化碳溶液褪色的是______(写名称),该反应的化学方程式为____。该物质在农业上用作水果的________。
(3)B的名称是_______,它的分子具有______(填分子构型)结构,是否存在单双键交替结构?___(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
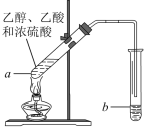
(1) 用化学方法可以鉴别乙醇和乙酸的试剂是______________(填字母);
a.稀硫酸 b.酸性KMnO4溶液
c.NaOH溶液 d.紫色的石蕊溶液
(2) 试管a中加入几块碎瓷片的目的是______________;
(3) 为了研究乙醇与乙酸反应的机理,若将乙醇中的氧原子用18O标记,写出标记后试管a中发生反应的化学方程式:_________________________________________ ;其反应类型是______________;
(4) 反应开始前,试管b中盛放的溶液是_____________ ;
(5) 反应结束后,常用____________操作把试管b中合成的酯分离出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com