
| 化学键 | H-H | C-O |  | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(2)氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量,根据盖斯定律可求;
(3)根据盖斯定律书写乙炔、氢气生成液体水的热化学反应方程式,根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,结合体积分数计算乙炔、氢气各自物质的量,结合热化学方程式计算放出的热量;
(4)反应热=反应物总键能-生成物总键能;根据盖斯定律:反应②-反应①=反应③,反应热也进行相应的计算.
解答 解:(1)2molC2H2完全燃烧生成二氧化碳和液态水放热Q1KJ,则C2H2的燃烧热为Q1/2 kJ/mol,故答案为:Q1/2 kJ/mol;
(2)由2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol,和H2O(g)═H2O(l)△H=-Q3kJ/mol可求出H2(g)+1/2O2(g)═H2O(l)△H=-(1/2Q2+Q3) kJ/mol,故答案为:H2(g)+1/2O2(g)═H2O(l)△H=-(1/2Q2+Q3) kJ/mol.
(3)已知:①、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-Q1kJ/mol;
②、2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
③、H2O(g)═H2O(l)△H=-Q3kJ/mol;
根据盖斯定律,②+2×③的2H2(g)+O2(g)=2H2O(l)△H═-Q2-2Q3,
112L体积比为4:1的C2H2和H2的混合气体的物质的量为$\frac{112L}{22.4L/mol}$=5mol,
解答:故C2H2的物质的量为5mol×$\frac{4}{5}$=4mol,完全燃烧生成液体水放出的热量为Q1×$\frac{4mol}{2mol}$=2Q1,
氢气的物质的量为5mol-4mol=1mol,完全燃烧生成液体水放出的热量为(Q2+2Q3)×$\frac{1mol}{2mol}$=0.5(Q2+2Q3),故C2H2、H2完全燃烧,放出的热量为:2Q1+0.5(Q2+2Q3)=2Q1+0.5Q2+Q3,故答案为:2Q1+0.5Q2+Q3.
(4)反应热=反应物总键能-生成物总键能,故△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1;
根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ.mol-1-(-99kJ.mol-1)=+41kJ.mol-1,故答案为:△H1=-99kJ.mol-1;△H3=+41kJ.mol-1.
点评 本题考查了共价键类型的判断及反应热的计算,热化学方程式和该死定律的计算应用,计算反应热时首先要知道分子中含有的化学键个数,只有明确含有的化学键数才能正确解答,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| B. | 当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 | |
| C. | 单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C的体积分数降低 | B. | x+y>z | ||
| C. | 平衡向正反应方向移动 | D. | x+y<z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持体积不变加入H2 | B. | 压缩体积至原来的一半 | ||
| C. | 降低温度 | D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和 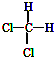 是两种种不同的物质 是两种种不同的物质 | |
| B. | 由乙烯之间的相互加成可以得到聚乙烯 | |
| C. | 丁烷与丁烯互为同系物 | |
| D. | 乙酸不能使紫色石蕊变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com