
【题目】I.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________,ΔH3=________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g) ![]() 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2 分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。
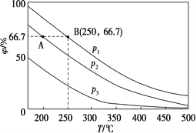
①其中,p1、p2 和p3 由大到小的顺序是____________,该反应ΔH _______0(填“>”“<”或“=”)。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2 的分压p(N2)为_______Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
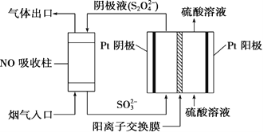
(3)①阴极区的电极反应式为___________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
Ⅳ.(4)常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________(用含a和b的代数式表示)。
【答案】高温 +247.1 p1>p2>p3 < < 8.3×103 2SO32-+4H++2e-=S2O42-+2H2O 1344 ![]()
【解析】
I.(1)反应自发进行的条件是△H-T△S<0,
水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+205.9kJmol-1①
CO(g)+H2O(g)CO2(g)+H2(g)△H2=-41.2kJmol-1②
二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g)△H3③
盖斯定律计算①-②得到反应③的热化学方程式;
Ⅱ.(2)①由方程式N2+3H22NH3可知,增大压强,平衡正向移动,氨的体积分数越大;
②温度越大,压强越大,反应速率越大;
③用三段式解,设转化的氮气的物质的量为x:

![]() =0.667,x=0.08。平衡分压=总压×气体物质的量分数;
=0.667,x=0.08。平衡分压=总压×气体物质的量分数;
(3)①阴极区失去电子生成S2O42-;
②结合NO~NH4+~5 e-计算。
Ⅳ.(4)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算.
I.(1)水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①,△H>0,△S>0,满足△HT△S<0,则需要高温。
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①,△H>0,△S>0,满足△HT△S<0,则需要高温。
水蒸气重整CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3③
2CO(g)+2H2(g) ΔH3③
盖斯定律计算①-②得到反应③的热化学方程式CH4(g)+CO2(g)2CO(g)+2H2(g)△H3=+247.1KJ/mol,
故答案为:高温;+247.1;
II.(2)①由N2+3H22NH3可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为p1>p2>p3,因此压强关系是p1>p2>p3,压强相同时,升高温度平衡逆向移动,故温度越高平衡混合物中氨的体积分数越小,故反应热小于零,
故答案为:p1>p2>p3;<;
②温度越,压强越大,反应速率越大,p1>p2,由图可知,B对应的温度、压强大,则反应速率大,
故答案为:<;
③③用三段式解,设转化的氮气的物质的量为x:

![]() =0.667,x=0.08。
=0.667,x=0.08。
若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)=![]() =8.3×103,
=8.3×103,
故答案为:8.3×103;
III.(3)①由图可知,阴极区通入液体主要含SO32,流出液主要含S2O42,所以阴极区电极反应式为SO32-+4H++2e-=S2O42-+2H2O,
故答案为:SO32-+4H++2e-=S2O42-+2H2O;
②由于NO吸收转化后的主要产物为NH4+,NONH4+5e,若电路中转移0.3mole,消耗NO0.06mol,标准状况下体积为=0.06mol×22.4L/mol=1.344L=1344mL,
故答案为:1344。
Ⅳ. (4)反应平衡时,2c(Ba2+)=c(CH3COO)=bmol/L,据电荷守恒,溶液中c(H+)=c(OH)=107mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K= ![]() =
=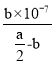 =
= ![]() ;
;
用含a和b的代数式表示该混合溶液中醋酸的电离常数为![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】有机物A和B的相对分子质量都小于200,完全燃烧时只生成CO2和H2O。B燃烧时消耗的氧气与生成的二氧化碳的物质的量相等。B中碳、氢元素总的质量分数为46.67%。B不发生银镜反应,但跟NaHCO3溶液反应放出CO2。1molA水解生成1mol苯甲酸和1molB。A溶液具有酸性,但遇FeCl3溶液不显色。
(1)A与B相对分子质量之差为___。
(2)B分子中应有___个氧原子。
(3)A的结构简式为___或___。
(4)写出B的属于酯的四种同分异构体的结构简式___、___、___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第VA族元素在生产、生活中有重要用途。回答下列问题:
(1)三聚磷酸钠(俗称“五钠”常用于食品生产中,作水分保持剂、品质改良剂等。
①磷酸的结构式如图所示,其主要的电离方程式为______________。
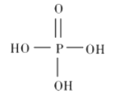
②三聚磷酸是三分子磷酸脱去两分子水后的产物,三聚磷酸钠的化学式为_______________。
(2)在碱性条件下,次磷酸盐(H2PO2-)可用于化学镀银,写出其反应的离子方程式______________。(氧化产物与还原产物物质的量之比为1:4)
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:

①除砷过程在75 ℃下进行,其合理的原因是____________(填字母代号)。
a,使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解 d.适当提高温度,增大反应速率
②硝酸氧化除砷时被还原为NO,写出砷转化为亚砷酸的化学方程式:______________________________。
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是__________________。
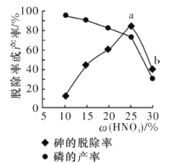
(4)常温下银氨溶液中存在平衡:Ag+(aq) + 2NH3(aq) ![]() Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)
Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________(保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________(保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL0.1 mol·L-1 NaOH溶液中加入0.1mol·L-1的一元酸HA,测得溶液pH的变化曲线如图所示,下列说法正确的是

A.a点所示溶液中c(Na+)>c(A-)>c(HA)>c(OH-)
B.b点所示溶液中c(A-)>c(HA)
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.a、b两点所示溶液中水的电离程度a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比。当电解装置插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀。根据上述现象,下列选项说法正确的是( )

A.通电时,铝片做阳极,铁片做阴极
B.生成的气泡、红棕色或灰绿色的沉淀都是电解的直接或间接产物
C.通过对比,确实能说明自来水中含有大量对人体有毒有害的物质
D.铁片的电极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以硫酸泥(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)为原料提取硒,流程如图:
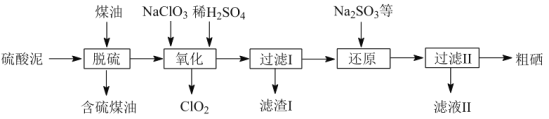
(1)“脱硫”过程中,温度控制在95℃,原因是___。
(2)“氧化”过程中,Se转化成H2SeO3,该反应的化学方程式为___。
(3)“还原”过程是通过控制电位还原的方法将电位高的物质先还原,电位低的物质保留在溶液中。下表是将“过滤Ⅰ”所得滤液中所含物质还原对应的电位。控制电位在0.782~1.692V,可除去“过滤Ⅰ”所得滤液中残留的ClO2。
名称 | Cu2+/Cu | Zn2+/Zn | Fe2+/Fe | Fe3+/Fe2+ | ClO2/Cl- | H2SeO3/Se |
电位/V | 0.435 | -0.885 | -0.463 | 0.782 | 1.692 | 0.743 |
为使硒和杂质金属分离,加入Na2SO3还原时,电位应控制在___范围;H2SeO3(弱酸)还原为硒的离子反应方程式为___。
(4)滤液Ⅱ中主要存在的金属阳离子有Zn2+、Na+、___。
(5)所得粗硒需精制。向粗硒浸出液中加入Na2S溶液可以将残留的Fe2+等微量杂质离子转化为沉淀而除去。已知25℃时Ksp(FeS)=6.0×10-18,要使溶液中Fe2+沉淀完全[c(Fe2+)≤1.0×10-5mol·L-1],则需控制溶液中c(S2-)≥___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
CO(g)+3H2(g)![]() CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
写出CO与H2O (g)反应生成H2和CO2的热化学方程式____________________________________。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是______________。
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b. c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为_______________,此反应的平衡常数为__________________(结果保留到小数点后三位)
②下列说法中能说明此反应达到平衡状态的是____________。
A.体系的压强不再发生变化 B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.反应速率V(CH4) :V(H2O) :v(CO) :v(H2)= 1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)![]() CO2(g) +3H2(g) ΔH = +49kJ·mol-1
CO2(g) +3H2(g) ΔH = +49kJ·mol-1
①分析适当增大水醇比[n(H2O) ∶n (CH3OH)]对甲醇水蒸气重整制氢的好处____________。
②某温度下,将[n(H2O) ∶n (CH3OH)]=l∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示。下列有关P4S3的说法中不正确的是( )

A.P4S3中各原子最外层均满足 8 电子稳定结构
B.P4S3中磷元素为+ 3 价
C.P4S3中 P 原子和 S 原子均为 sp3杂化
D.1molP4S3分子中含有 6mol 极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表
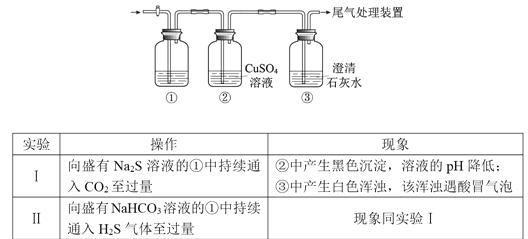
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A.③中白色浑浊是CaCO3
B.②中溶液pH降低的原因是:H2S+Cu2+=CuS↓+2H+
C.实验①中CO2过量发生的反应是:CO2+H2O+S2-=CO32-+H2S
D.由实验I和II不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com