
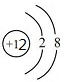
 ,Mg与Cl形成的化合物为MgCl2,电子式为
,Mg与Cl形成的化合物为MgCl2,电子式为 ,
, ;
; .
.


科目:高中化学 来源: 题型:
 全氮型超高能材料是指能量比常规炸药至少高一个数量级的新型高能物质,它最突出的特性是分子中蕴含有巨大的能量.
全氮型超高能材料是指能量比常规炸药至少高一个数量级的新型高能物质,它最突出的特性是分子中蕴含有巨大的能量.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-的水解:HCO3-+H2O?CO32-+H3O+ |
| B、Na2S的水解:S2-+2H2O?H2S+2OH- |
| C、Fe3+的检验:Fe3++3SCN-?Fe(SCN)3↓ |
| D、Cu(OH)2溶于氨水形成深蓝色溶液:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥ | B、②③⑤ |
| C、②④⑤ | D、①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③ | C、②④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、时速达280公里的飓风与海水发生剧烈摩擦,产生的巨大热能使水分子分解,引起氢气燃烧 |
| B、飓风使海水分子运动速度加快,产生的热能使海水中植物燃烧 |
| C、海面上漂浮的油层被氧化而燃烧 |
| D、以上叙述都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

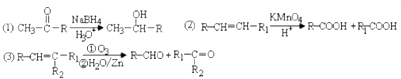
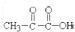 是E的最简单的同系物,试以丙酮酸为原料合成乙二酸(用合成路线流程图表示,并注明反应条件)
是E的最简单的同系物,试以丙酮酸为原料合成乙二酸(用合成路线流程图表示,并注明反应条件)| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com