
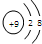 该粒子的说法不正确的是( )
该粒子的说法不正确的是( )| A、核电荷数为9 |
| B、核外有两个电子层 |
| C、属于阴离子 |
| D、在化学反应中容易得到1个电子 |
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、从海水提取物质都必须通过化学反应才能实现 |
| B、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| C、“绿色化学”的核心是利用化学原理进行环境治理 |
| D、生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
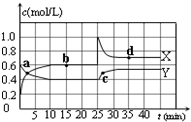 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 130℃ |
| 催化剂 |
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、实验室中用稀HNO3溶液与Cu反应制取NO气体反应很慢,加一块石墨使之与Cu接触后反应加快 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 具有多种同素异形体,形成的化合物种类繁多 |
| Y | 短周期主族元素中原子半径最大 |
| Z | 位于元素周期表金属与非金属元素的分界线上,最高化合价为+4 |
| W | 富集在海水中的元素,它的某些化合物常用作消毒刹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、5NH4NO3
| ||||
| B、室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | ||||
| C、氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | ||||
| D、高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、21:5 | B、11:3 |
| C、3:1 | D、4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 三氯化铁是合成草酸铁的重要原料.
三氯化铁是合成草酸铁的重要原料.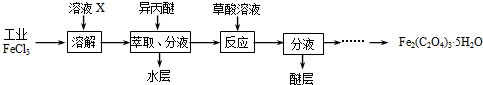
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com