
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI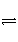
 H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
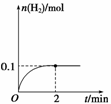
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)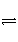
 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l)
ΔH=-572 kJ·mol-1
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
________。
答案 (1)c (2)0.1 mol·L-1·min-1 64 b (3)向右 b (4)80%
解析 本题主要考查了化学反应速率与化学平衡、水的电离平衡和化学计算。
(1)a项错误,反应Ⅲ在常温下向左进行;b项,SO2的还原性比HI强;c项,根据盖斯定律Ⅰ×2+Ⅱ×2+Ⅲ得总反应:2H2O===2H2+O2,循环过程中消耗了H2O;d项,根据总反应知产生1 mol O2的同时产生2 mol H2。
(2)由题干数据分析该反应:
H2 + I2 === 2HI
起始: 0 0 1 mol
转化: 0.1 mol 0.1 mol 0.2 mol
平衡: 0.1 mol 0.1 mol 0.8 mol
0~2 min内平均反应速率v(HI)=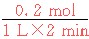 =0.1 mol·L-1·min-1
=0.1 mol·L-1·min-1
平衡常数K=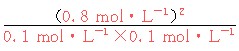 =64
=64
第三问,若开始加入HI的物质的量是原来的2倍,相当于先将HI加入到2 L的容器(达到的平衡状态与原平衡一致,即HI的浓度、H2的体积分数与原平衡相同),再将体积压缩至1 L,因为该反应为等体积反应,加压平衡不移动,所以HI的浓度为原来的2倍,H2的体积分数不变;温度不变,平衡常数不变;加入HI的物质的量增大,反应物浓度增大,反应速率加快,达到平衡的时间缩短。
(3)Zn与稀H2SO4反应,c(H+)减小,水的电离平衡向右移动;若向原溶液中加入NaNO3,Zn与H+、NO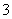 反应不生成H2;若加CuSO4,Zn+CuSO4===ZnSO4+Cu,Zn与Cu构成原电池,加快反应速率;若加Na2SO4,对反应速率没有影响;若加NaHSO3,HSO
反应不生成H2;若加CuSO4,Zn+CuSO4===ZnSO4+Cu,Zn与Cu构成原电池,加快反应速率;若加Na2SO4,对反应速率没有影响;若加NaHSO3,HSO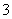 消耗H+生成H2O和SO2,反应速率减小。
消耗H+生成H2O和SO2,反应速率减小。
(4)生成1 mol液态水,理论上放热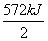 =286 kJ,则该电池的能量转化率为
=286 kJ,则该电池的能量转化率为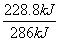 ×100%=80%。
×100%=80%。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
有下列各组微粒或物质,请按要求填空:
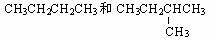 A.O2和O3 B.
A.O2和O3 B.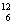 C和
C和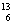 C C.
C C.
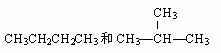 | |||
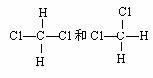 | |||
D E.
(1) 组两种微粒互为同位素 ;
(2) 组两种物质互为同素异形体;
(3) 组两种物质属于同系物 ;
(4) 组两物质互为同分异构体;
(5) 组两物质是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
只用一种试剂可区别Na2SO4 、MgCl2 、FeCl2 、Al2(SO4)3 、(NH4)2SO4五种溶液,
这种试剂是
A.NaOH B.H2SO4 C.Ba(OH)2 D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石) ΔH=+1.9 kJ·mol-1”可知,金刚石比石墨稳定
C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为
2H2(g)+O2(g)===2H2O(l) ΔH=+285.8 kJ·mol-1
D.在稀溶液中:H++OH-===H2O ΔH=-57.3 kJ·mol-1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
①2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1;
②H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1;
③C(s)+1/2O2(g)===CO(g) ΔH=-110.5 kJ·mol-1;
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1;
⑤CO2(g)+2H2O(g)===2CH4(g)+2O2(g) ΔH=+890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是___________________________________________。
(2)H2的燃烧热为_______________________________________________________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s)+H2O(g)===H2(g)+CO(g) ΔH=a kJ·mol-1;则a=________;该反应的熵ΔS________0(选填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表中,磷元素的某些信息如下图所示。下列说法不正确的是( )
 A.磷元素为非金属元素
A.磷元素为非金属元素
B.磷原子核外有15个电子
C.磷的原子序数为15
D.相对原子质量为30.97g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐增强
D.LiOH、NaOH、KOH的碱性依次逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质( )
A.立刻褪色 B.慢慢褪色 C.先褪色,后复原 D.颜色不褪
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)
 CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com