
”¾ĢāÄæ”æijĶ¬Ń§ĪŖĢ½¾æŌŖĖŲÖÜĘŚ±ķÖŠŌŖĖŲŠŌÖŹµÄµŻ±ä¹ęĀÉ£¬Éč¼ĘĮĖČēĻĀĻµĮŠŹµŃé£ŗ
¢ń£®Ģ½¾æĶ¬ÖÜĘŚŌŖĖŲŠŌÖŹµÄµŻ±ä¹ęĀÉ
£Ø1£©ĻąĶ¬Ģõ¼žĻĀ£¬½«ÄĘ”¢Ć¾”¢ĀĮø÷1 mol·Ö±šĶ¶Čėµ½×ćĮæµÄĶ¬ÅØ¶ČµÄĻ”ŃĪĖįÖŠ£¬ŹŌŌ¤²āŹµŃé½į¹ū£ŗ_______ÓėĻ”ŃĪĖį·“Ó¦×ī¾ēĮŅ£»______ÓėĻ”ŃĪĖį·“Ó¦²śÉśµÄĘųĢå×ī¶ą”£
£Ø2£©ĻņNa2SČÜŅŗÖŠĶØČėĀČĘų³öĻÖ»ĘÉ«»ė×Ē£¬æÉÖ¤Ć÷ClµÄ·Ē½šŹōŠŌ±ČSĒ棬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________________________”£
¢ņ£®Ģ½¾æĶ¬Ö÷×åŌŖĖŲ·Ē½šŹōŠŌµÄµŻ±ä¹ęĀÉ
Ä³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼ĘĮĖŅ»×鏵Ń饓Ģ½¾æ¢÷A×åŌŖĖŲŌ×ӵĵƵē×ÓÄÜĮ¦ĒæČõ¹ęĀÉ”£ĻĀĶ¼ÖŠA”¢B”¢CŹĒČżøöæɹ©Ń”ŌńÖĘČ”ĀČĘųµÄ×°ÖĆ£¬×°ÖĆDµÄ²£Į§¹ÜÖŠ¢Ł”¢¢Ś“¦ŅĄ“Ī·ÅÖĆÕŗÓŠNaBrČÜŅŗ”¢NaOHÅØČÜŅŗµÄĆŽĒņ”£
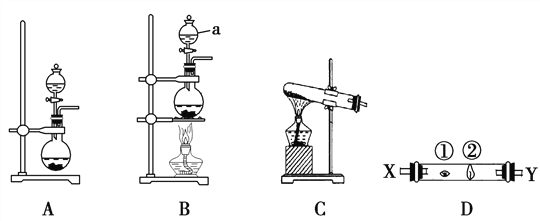
£Ø3£©Š“³ö×°ÖĆBÖŠŅĒĘ÷aµÄĆū³Ę ________________”£
£Ø4£©ŹµŃéŹŅÖĘČ”ĀČĘų»¹æɲÉÓĆČēĻĀŌĄķ£ŗ2KMnO4£«16HCl(ÅØ)===2KCl£«2MnCl2£«5Cl2”ü£«8H2O£¬ŅĄ¾ŻøĆ·“Ó¦ŌĄķŃ”Ōń_____________£ØĢī”°A”±»ņ”°B”±»ņ”°C”±£©×°ÖĆÖĘČ”ĀČĘų”£
£Ø5£©·“ӦװÖƵĵ¼Ęų¹ÜĮ¬½Ó×°ÖĆDµÄXµ¼¹Ü£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
¢Ł“¦·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ________________________________£»
¢Ś“¦·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ________________________________”£
”¾“š°ø”æ ÄĘ£Ø»ņNa£© ĀĮ£Ø»ņAl£© S2££«Cl2=2Cl££«S”ż ·ÖŅŗĀ©¶· A Cl2£«2Br£===2Cl££«Br2 Cl2£«2OH£===Cl££«ClO££«H2O
”¾½āĪö”æ¢ń£®£Ø1£©½šŹō»īĘĆŠŌĖ³ŠņĪŖ£ŗÄĘ£¾Ć¾£¾ĀĮ£¬ĖłŅŌĻąĶ¬Ģõ¼žĻĀÓėŃĪĖį·“Ó¦×ī¼¤ĮŅµÄŹĒÄĘ£¬·“Ó¦ĖŁĀŹ×īĀżµÄŹĒĀĮ£»Éś³É1molĒāĘųŠčŅŖµĆµ½2molµē×Ó£¬1molÄʶ¼Ź§Č„1molµē×Ó£¬1molĆ¾Ź§Č„2molµē×Ó£¬¶ų1molĀĮŹ§Č„3molµē×Ó£¬ĖłŅŌÉś³ÉĒāĘų×ī¶ąµÄŹĒ½šŹōĀĮ£¬
¹Ź“š°øĪŖ£ŗÄĘ£»ĀĮ£»
£Ø2£©ĀČĘųŃõ»ÆŠŌĒæÓŚĮņµ„ÖŹ£¬ĖłŅŌĀČĘųÄܹ»ÓėĮņĄė×Ó·“Ӧɜ³ÉĮņ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗS2-+Cl2ØTS”ż+2Cl-”£¹Ź“š°øĪŖ£ŗS2-+Cl2ØTS”ż+2Cl-£®
¢ņ£®(3)ÓÉĶ¼ÖŖaĪŖ·ÖŅŗĀ©¶·£¬±¾ĢāÕżČ·“š°øŹĒ:·ÖŅŗĀ©¶·;
(4)øßĆĢĖį¼ŲÓėÅØŃĪĖį·“Ó¦½ĻĪŖ¾ēĮŅ,ĪŽŠč¼ÓČČ¼“æɽųŠŠ,Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ:A;
(5)¼ģŃéĀČĘųµÄŠŌÖŹŹ±,²»ÄÜĻČĶعżNaOHČÜŅŗ,·ńŌņ»įĻūŗÄĀČĘų,ĒŅĘš²»µ½Ī²ĘųĪüŹÕµÄ×÷ÓĆ, ŅņĪŖ¢Ł“¦ĪŖNaBrČÜŅŗ”¢¢Ś“¦ĪŖNaOHČÜŅŗ£¬ĖłŅŌÓ¦“ÓX¶Ė½ųĀČĘų”£
¢ŁĻČ¢ŁÓėNaBrČÜŅŗ·“Ӧɜ³ÉBr2,·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖCl2£«2Br£===2Cl££«Br2 ,
¢ŚŌŚÓė¢Ś“¦ĪŖNaOHČÜŅŗ·“Ó¦£¬ĘäĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ Cl2£«2OH£===Cl££«ClO££«H2O”£“š°ø£ŗCl2£«2Br£===2Cl££«Br2 Cl2£«2OH£===Cl££«ClO££«H2O



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌÓŚ2 mol O2 ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ(”” ””)
A. ŗ¬ÓŠ2NAøöŃõ·Ö×Ó B. ŗ¬ÓŠ2molŃõŌ×Ó
C. ÖŹĮæĪŖ64g D. ±źæöĻĀĢå»żĪŖ44.8L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”¢B”¢CŹĒ֊ѧ»Æѧ³£¼ūµÄČżÖÖĪļÖŹ£¬ĖüĆĒÖ®¼äµÄĻą»„×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø²æ·Ö·“Ó¦Ģõ¼ž¼°²śĪļĀŌČ„£©”£
![]()
£Ø1£©ČōAŹĒŅ»ÖÖµ»ĘÉ«µ„ÖŹ¹ĢĢ壬ŌņB”śCµÄ»Æѧ·½³ĢŹ½ĪŖ___________________”£
£Ø2£©ČōAŹĒŅ»ÖÖŗŚÉ«µ„ÖŹ¹ĢĢ壬½«Ņ»¶ØĮæC»ŗĀżĶØČėNaOHČÜŅŗÖŠ£¬³ä·Ö·“Ó¦£¬²āµĆ×īŗóČÜŅŗµÄĻŌ¼īŠŌ£¬“ĖŹ±ČÜŅŗµÄČÜÖŹČē¹ūŹĒµ„Ņ»³É·Ö£¬æÉÄÜŹĒ__________”¢__________£»Čē¹ūŹĒ¶ąÖֳɷ֣¬æÉÄÜŹĒ__________”¢__________”£
£Ø3£©ČōAŹĒŅ»ÖÖ»īĘĆ½šŹō£¬CŹĒµ»ĘÉ«¹ĢĢ壬ŹŌÓĆ»Æѧ·½³ĢŹ½±ķŹ¾øĆĪļÖŹCµÄŅ»øöÖŲŅŖÓ¦ÓĆ________________________________________”£ ½«C³¤ĘŚĀ¶ÖĆÓŚæÕĘųÖŠ£¬×īŗ󽫱ä³ÉĪļÖŹD£¬DµÄ»ÆѧŹ½ĪŖ_____________”£ĻÖÓŠDŗĶNaHCO3µÄ¹ĢĢå»ģŗĻĪļ10g£¬¼ÓČČÖĮÖŹĮæ²»ŌŁøı䣬Ź£Óą¹ĢĢåÖŹĮæĪŖ9.38g£¬DµÄÖŹĮæ·ÖŹżĪŖ_____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆĻĀĮŠŹµŃé×°ÖĆ¼°Ņ©Ę·ÄÜĶź³ÉĻąÓ¦ŹµŃéµÄŹĒ£Ø £©
A. ČēĶ¼ÓĆÓŚÖ¤Ć÷·Ē½šŹōŠŌĒæČõ£ŗCl£¾C£¾S
ČēĶ¼ÓĆÓŚÖ¤Ć÷·Ē½šŹōŠŌĒæČõ£ŗCl£¾C£¾S
B. ČēĶ¼ÓĆÓŚ·ÖĄėI2ŗĶNH4Cl
ČēĶ¼ÓĆÓŚ·ÖĄėI2ŗĶNH4Cl
C. ČēĶ¼ÓĆÓŚ²ā¶ØijNaOHČÜŅŗµÄÅضČ
ČēĶ¼ÓĆÓŚ²ā¶ØijNaOHČÜŅŗµÄÅضČ
D.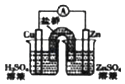 Čē×°ÖĆÄÜ×é³ÉCu©ZnŌµē³Ų
Čē×°ÖĆÄÜ×é³ÉCu©ZnŌµē³Ų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķĖłĮŠø÷×éĪļÖŹÖŠ£¬ĪļÖŹÖ®¼äĶعżŅ»²½·“Ó¦²»ÄÜŹµŃāČēĶ¼ĖłŹ¾×Ŗ»ÆµÄŹĒ£Ø £©
Ń”Ļī | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A.A
B.B
C.C
D.D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦ÖŠ£¬ÄÜÖ¤Ć÷SiO2ŹĒĖįŠŌŃõ»ÆĪļµÄŹĒ
¢ŁSiO2+4HF===SiF4”ü+2H2O
¢ŚSiO2+CaO![]() CaSiO3
CaSiO3
¢ŪSiO2+2NaOH===Na2SiO3+H2O
¢ÜSiO2+2C![]() Si+2CO”ü
Si+2COӟ
A. ¢Ł¢Ś B. ¢Ś¢Ū C. ¢Ū¢Ü D. ¢Ł¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ(””””)
A.Ö½²ćĪöŹĒÉ«Ę×·ÖĪö·ØµÄŅ»ÖÖ£¬æÉÓĆÓŚ·ÖĄė½į¹¹Ļą½ü”¢ŠŌÖŹĻą²ī½ĻĆ÷ĻŌµÄĪļÖŹ
B.µē½ā¾«Į¶”¢½į¾§”¢¼ÓČȵȷ½·ØŹĒ·ÖĄė”¢Ģį“æ¹ĢĢåѳʷµÄ»ł±¾·½·Ø
C.ÓĆ²£Į§°ō½Į¶Æ»ņĶ¶Čė¼øĮ£¾§ĢåŹĒĘĘ»µČÜŅŗ·¢Éś¹ż±„ŗĶĻÖĻóµÄ³£ÓĆ·½·Ø
D.ĪüĀĖ½ö½öÄܼÓæģ¹żĀĖĖŁ¶ČŗĶµĆµ½øüøÉŌļµÄ³Įµķ£¬µ«²»ÄÜŹ¹³ĮµķæÅĮ£±ä“Ö±ä“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½«ÉŁĮæĀČĖ®¼ÓČėKIČÜŅŗÖŠÕńµ“,ŌŁ¼ÓČėCCl4,Õńµ“,¾²ÖĆŗó¹Ū²ģµ½µÄĻÖĻóŹĒ
A. ŠĪ³É¾łŌȵÄ×ĻÉ«ČÜŅŗB. ÓŠ×ĻÉ«³ĮµķĪö³ö
C. ŅŗĢå·Ö²ć,ÉĻ²ć³Ź×ĻŗģÉ«D. ŅŗĢå·Ö²ć,ĻĀ²ć³Ź×ĻŗģÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»ČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÄŚ¼ÓČė0.2molµÄN2ŗĶ0.6molµÄH2 £¬ ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗN2£Øg£©+3H2£Øg£©2NH3£Øg £©”÷H£¼0£¬·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆµÄĒéæöČēĶ¼£ŗ 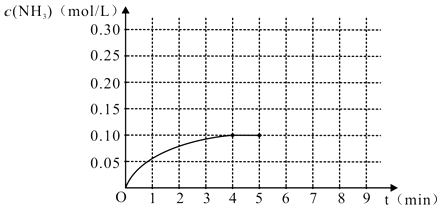
£Ø1£©øł¾ŻÉĻĶ¼£¬¼ĘĖć“Ó·“Ó¦æŖŹ¼µ½Ę½ŗāŹ±£¬Ę½¾ł·“Ó¦ĖŁĀŹv£ØNH3£©ĪŖ £®
£Ø2£©·“Ó¦“ļµ½Ę½ŗāŗ󣬵Ś5·ÖÖÓÄ©£¬±£³ÖĘäĖüĢõ¼ž²»±ä£¬Čōøı䷓ӦĪĀ¶Č£¬ŌņNH3µÄĪļÖŹµÄĮæÅØ¶Č²»æÉÄÜĪŖ £®
A.0.20mol/L
B.0.12mol/L
C.0.10mol/L
D.0.08mol/L
£Ø3£©·“Ó¦“ļµ½Ę½ŗāŗ󣬵Ś5·ÖÖÓÄ©£¬±£³ÖĘäĖüĢõ¼ž²»±ä£¬ČōÖ»°ŃČŻĘ÷µÄĢå»żĖõŠ”Ņ»°ė£¬Ę½ŗāŅĘ¶Æ£ØĢī”°ĻņÄę·“Ó¦·½Ļņ”±”¢”°ĻņÕż·“Ó¦·½Ļņ”±»ņ”°²»”±£©
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com