
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A ______ B_______ C _____ D ________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)画出D的核外电子排布图_____________________________________,这样排布遵循了____________原理和____________规则。
(7)用电子式表示B的硫化物的形成过程:___________________________
【答案】(1)Si;Na;P;N;(2)HNO3;NaOH(3):F;F(4)高;NH3分子间形成氢键;(5)26;四、Ⅷ;d;(6)![]() ;泡利;洪特;
;泡利;洪特;
(7)![]()
【解析】试题分析:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,则E为Fe元素.(1)由上述分析可知,A为Si、B为Na、C为P、D为N;(2)上述五种元素中,N的非金属性最强,Na的金属性最强,故HNO3的酸性最强,NaOH的碱性最强;(3)同周期自左而右,第一电离能呈增大趋势(个别除外),所以第一电离能最大的元素是F,周期自左而右,电负性增大,故电负性最大的元素是F;(4)D的氢化物NH3、C的氢化物为PH3,因为NH3分子间能形成氢键,使NH3的沸点高于PH3的;
(5)E为Fe元素,E的核外电子排布式为1s22s22p63s23p63d64s2,故核电荷数是26,Fe在周期表中处于第四周期第Ⅷ族,在周期表中处于d 区;
(6)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子,所以其核外电子排布图为:![]() ,这样排布遵循了泡利不相容原理、洪特规则;
,这样排布遵循了泡利不相容原理、洪特规则;
(7)B的硫化物为Na2S,用电子式表示形成过程:,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
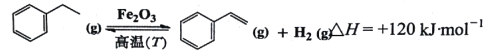
(1)升高反应温度,其转化率________,反应速率________(填“增大”、“减小”或“不变”)。
(2)等温、等压下,通入惰性气体(如水蒸气)能提高反应的转化率,其原因是________。
(3)通入水蒸气可延续催化剂Fe2O3被还原而失活,其原因是________(用化学平衡原理解释)。
(4)一定条件下,在体积不变的密闭容器中,反应过程中各物质浓度随时间变化的关系如下图所示。在t1时刻加入H2,t2时刻再次达到平衡。回答下列问题:
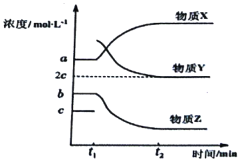
①物质X为__________,判断理由是__________;
②t2时刻,苯乙烯的浓度为______molL-1;
③t1-t2时间段内,乙苯的反应速率为_______molL-1min-1;
(5)温度T下,已知H2和苯乙烯的燃烧热△H分别为-290kJmol-1和-4400kJmol-1,则乙苯的燃烧热为△H_______kJmol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备溴苯的实验装置如下图,将液溴从恒压滴液漏斗慢慢滴入盛有苯和铁粉的烧瓶A。反应结束后,对A中的液体进行后续处理即可获得溴苯。

(1)写出A中制备溴苯的化学反应方程式 。
(2)B中盛放的CCl4的作用是 。
(3)冷凝管的作用是 ,冷凝管中的水应从 口进入(填“a”或“b”)。
(4)向C中加入硝酸银溶液可证明苯和液溴发生的是取代反应而不是加成反应,反应现象是 ,也可使用 试纸更简便地证明上述结论。
(5)得到粗溴苯后,要用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④10%NaOH溶液洗,正确的操作顺序是 (填字母标号)。
a.①②③④② b.②④②③① c.④②③①② d.②④①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s)+CO2(g) H1
1/4CaS(s)+CO2(g) H1
②CaSO4(s)+CO(g) ![]() CaO(s)+CO2(g) +SO2(g) H2
CaO(s)+CO2(g) +SO2(g) H2
③CO(g) ![]() 1/2C(s)+1/2CO2(g) H3
1/2C(s)+1/2CO2(g) H3
则反应2CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)的H=
CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)的H=
(用H1、H2和H3表示)
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
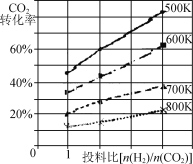
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH____(填“>”“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将 (填“增大”“减小”或“不变”)。
③二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为 。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2nCu+(n+1)O2+(2-2n) H2O=2nCuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
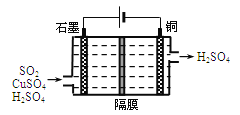
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的总的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下列实验,来研究硫酸和硝酸的性质。

实验一:在一支试管中放入一块很小的铜片,再加入2 mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。待试管中的液体冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察现象。
回答下列问题:
(1)a处反应的化学方程式为________________________________,计算放出112 mL气体(标准状况),转移电子的物质的量为________________。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为________________________。
待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为__________________________________________________________________。
实验二:为了证明铜与稀硝酸反应产生一氧化氮,某同学设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去)。A为注射器,B为两端长短不等的U形管,C是装有NaOH溶液的烧杯,D处是绕成螺旋状的铜丝,K1、K2是止水夹。

(1)实验时,为在D处收集到NO,以便观察颜色,必须事先在A中吸入一定量的空气。然后__________K1(“关闭”或“打开”),从U形管左端注入稀硝酸,当看到________________________现象可以确定U形管中空气已被赶尽。
(2)然后给装置B微微加热,在装置D处产生无色气体,其反应的离子方程式为:
________________________________________________________________________。
(3)如何证明D处聚集的是NO而不是H2?
________________________________________________________________________。
(4)实验现象观察完毕,关闭止水夹K1,打开止水夹K2,在重力作用下,U形管右端的红棕色混合气体被酸液压入NaOH溶液中吸收,消除了环境污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2的离子化合物。
(1)写出Y2O2的电子式:____ _,其中含有的化学键是___ _。
(2)用电子式表示Y2O的形成过程________ _______。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶浓氧化性最强的是_____(填化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是__________(填化学式)。
(5)由X、Y组成的化合物分子中.X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式_______________ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】IA、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构。

(1)试判断A、B、C、D四种元素的名称。A______,B_____,C______,D______。
(2)C在周期表中的位置是 。
(3)由B、D两种元素组成的D2B2型化合物的电子式为_______,CB2的电子式 为________。
(4)如右图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到_____,原因是_____________。
II(9分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族K] | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | [m] | ⑩ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: 。
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______(要求用离子符号表示)。
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将57.6克的铜投入200毫升的硝酸溶液中恰好反应完全,产生标准状况下的NO2 、NO共1.4 mol。
(1)写出刚开始反应的化学方程式
(2)求硝酸的浓度 mol·L-1
(3)将生成的气体收集在大试管中,然后倒扣在水中,写出二氧化氮与水反应的化学方程式 ,若反应完全,则最后试管中NO的物质的量 mol。若往试管中通入氧气让液体充满试管问通入氧气的物质的量 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。


③烃A是有机合成的重要原料。A的质谱图表明其相对分子质量为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物C的核磁共振氢谱显示其分子中含有5种化学环境不同的氢原子,且个数之比为3:2:2:2:l。回答下列问题:
(1)A的结构简式为________;A在一定条件下生成聚合物的化学方程式为___________________
(2)D中的含氧官能团是___________。有机物D和足量有机物C反应生成DBP的化学方程式是____________________________________________
(3)下列说法正确的是___________ (选填序号字母)。
A.A能发生聚合反应、加成反应和氧化反应
B.与C互为同分异构体,且含有相同官能团的有机物有2种
C.邻二甲苯能氧化生成D说明有机物分子中基团之间存在影响
D.1 mol DBP可与含4mol NaOH的溶液完全反应
(4)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
i)E+C![]() 中间产物
中间产物
ii)中间产物+C ![]() DBP+H2O
DBP+H2O
①请写出E的结构简式___________。
②工业上生产有机物E的反应如下:2X+9O2![]() 2E+4CO2+4H2O,芳香烃X的一溴代物只有两种,则X的结构简式是___________。
2E+4CO2+4H2O,芳香烃X的一溴代物只有两种,则X的结构简式是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com