
����Ŀ��ӡˢ��·���ڿƼ�������в�����������ã������Ʊ�����Ϊ�߷��ӻ������ͭ��ѹ�ϣ�ͨ��FeCl3��Һ����ʴ�����ɡ�ijʵ��С����ʵ�����÷�����ӡˢ��·��͡���ʴҺ����ȡͭ��һ�ֹ����������£�
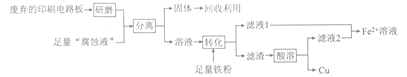
��ش��������⣺
(1) ���顰��ʴҺ���к���Fe2+�ķ���Ϊ_________________��
(2)�����롱���õIJ�������Ϊ____________���ò������õ���Ҫ�����������ձ���_____________��
(3)�õ�ⷨ�����϶�ͭʱ����������Ϊ_____________���ѧʽ���������ϵ�ƹ����е������Һ��Ũ��_______________ (�������С�����䡱����
(4) Fe2+��Һ�кܶ���Ҫ��;��
����֪�������£�Ksp[Fe(OH)2]=1.8��10-16������1.8mol��L-1��FeSO4��Һʱ��Ϊȷ����Һ�в����ֻ��ǣ�Ӧ������Һ��pH������_________________��
��Fe2+��ʹAg+��Fe3+֮���ת����һ���¶��£�0.1 mol��L-1��Fe(NO3)2��Һ�У�c(Fe3+)��c(Ag+)�Ĺ�ϵ��ͼ��ʾ��
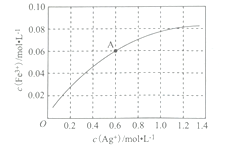
���¶��£�A����Һ��ת����Ӧ��ƽ�ⳣ��Ϊ____________(��Һ����仯���Բ��ƣ�������0.6mol��L-1 Fe(NO3)2��Һ��0.15 mol��L-1 Fe(NO3)3��Һ��0.06 mol L-1 AgNO3��Һ�������Ϻ��ټ���1.08 g Ag,�ɹ۲쵽������Ϊ_________________________��
��Fe2+ת��ΪFe3+�������Ʊ��������Ρ���FeCl3��Һ�м���NaOH��NaClO��Һ�Ʊ�Na2FeO4�Ļ�ѧ����ʽΪ_________________________��
���𰸡� ȡ��������ʴҺ���ڽྻ���Թ��У��μ�K3[Fe(CN)6]��Һ������������ɫ��������Fe2+ ���� ©���������� Fe ���� 6 2. 5 Ag�����ܽ⣬��Һ��ɫ��dz 2FeCl3+3NaClO+l0NaOH=2Na2FeO4 +9NaCl+5H2O
����������1���ں��������ӡ��������Ӻ�ͭ���ӵĻ����Һ�м����������ӵĴ��ڣ��Ϻ������Լ�Ϊ���軯����Һ����ʴҺ���к���Fe2+�ķ���Ϊ��ȡ��������ʴҺ���ڽྻ���Թ��У��μ�K3[Fe(CN)6]��Һ������������ɫ��������Fe2+����2����������ͼ�е�3��֪���������Ϊ���ˣ��������õ���Ҫ�����������ձ���©��������������3�����ʱ���Ƽ�Ϊ��������������϶�ͭ�������������������ʱ�������Һ��Ũ�������ϱ��ֲ��䡣��4����c(Fe2��)��c2(OH��)��Ksp[Fe(OH)2]��1.8��10��16ʱ������ֻ��ǣ���c(OH��)��10��8mol/L����������Ũ����10��6mol/L��pH��6������ͼ�����ݿ�֪�����¶��£�A����Һ��c(Ag��)��c(Fe3+)��0.6mol/L�����ݷ���ʽFe2+��Ag��![]() Fe3+��Ag��֪c(Fe2+)��0.04mol/L����K��0.06/(0.04��0.6)��2.5���������������ݿɵ�Ũ���أ�0.05/(0.2��0.02)��12.5��K�����Է�Ӧ������У����ʵ��������Ag�����ܽ⣬��Һ��ɫ��dz������Ԫ�ػ��ϼ۴�+3�����ߵ�+6�ۣ�ʧȥ3�����ӣ�ClԪ�ػ��ϼ۴�+1�۽��͵���1�ۣ��õ�2�����ӣ����ݵ��ӵ�ʧ�غ㡢����غ��ԭ���غ��֪�Ʊ�Na2FeO4�Ļ�ѧ����ʽΪ2FeCl3+3NaClO+l0NaOH��2Na2FeO4 +9NaCl+5H2O��
Fe3+��Ag��֪c(Fe2+)��0.04mol/L����K��0.06/(0.04��0.6)��2.5���������������ݿɵ�Ũ���أ�0.05/(0.2��0.02)��12.5��K�����Է�Ӧ������У����ʵ��������Ag�����ܽ⣬��Һ��ɫ��dz������Ԫ�ػ��ϼ۴�+3�����ߵ�+6�ۣ�ʧȥ3�����ӣ�ClԪ�ػ��ϼ۴�+1�۽��͵���1�ۣ��õ�2�����ӣ����ݵ��ӵ�ʧ�غ㡢����غ��ԭ���غ��֪�Ʊ�Na2FeO4�Ļ�ѧ����ʽΪ2FeCl3+3NaClO+l0NaOH��2Na2FeO4 +9NaCl+5H2O��


 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ���ˮ�У����������ȵ���
A. ʳ�� B. ���� C. ����� D. ��ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ4NH3��5O2��4NO��6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)(mol��L-1��min-1)��ʾ�������й�ϵ��ȷ���ǣ� ��
A. 4v(NH3)��5v(O2) B. 6v(O2)��5v(H2O) C. 2v(NH3)��3v(H2O) D. 5v(O2)��4v(NO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ˮ����������ȷ���ǣ� ��
A.������ˮ��ֻ���������ʹ��������
B.������ˮ��ʹ��ɫʯ����Һ�ȱ�����ɫ
C.��ˮ����ʱ�������ݳ������������Ҫ�ɷ�������
D.��ˮ����������䵼����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�����ٽ�ˮ�ĵ��룬��ʹ��ҺpH>7����( )
A������ˮ���ȵ�90 �� B����ˮ�м�������NaOH
C����ˮ�м�������Na2CO3 D����ˮ�м�������FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[Ca(NO2)2]��ˮ���������Ӽ�����Ҫԭ�ϣ�ijѧϰС�����ʵ���Ʊ�������ƣ�ʵ��װ����ͼ��ʾ���г�װ����ȥ����
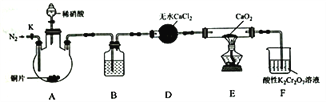
��֪��2NO+CaO2 =Ca(NO2)2��2NO2+CaO2=Ca(NO3)2��
��ش��������⣺
��1������Һ©���е�ϡ�������������ƿ�еIJ���Ϊ______________��
��2����������ƿ�м���ϡ����֮ǰ��Ӧ��װ����ͨ��һ��ʱ���N2��ԭ��Ϊ_________________��
��3��װ��D�е���������Ϊ_______________��װ��B�����Լ�Ϊ_______________��
��4��װ�DF�У�����K2Cr2O7��Һ�ɽ�ʣ���NO����ΪNO3-����Һ�ɳ�ɫ��Ϊ��ɫ(Cr3+)��������Ӧ�����ӷ���ʽΪ_________________��
��5����֪��Ca(NO2)2��Һ��������NO���塣���ʵ��֤��װ��E��������������ɣ�____________��
��6����ҵ�Ͽ���ʯ��������Ṥҵ��β������NO��NO2)��Ӧ�����ܾ������������ܻ��Ӧ�ù㷺�� Ca(NO2)2����Ӧԭ��ΪCa(OH)2 + NO+NO2=Ca(NO2)2 + H2O��
����n(NO)��n(NO2)>l��l����ᵼ��______________________________��
����n(NO)��n(NO2)<1��1����ᵼ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĹ�ҵ�Ʒ���ȷ����
A.���ѣ��ý������û����Ȼ��ѣ�TiCl4����Һ�е���
B.������������¯��̼�ڸ����»�ԭ����ʯ�е���
C.���ƣ��ú�ˮ��ԭ���Ƶþ��Σ��ٵ�����ڵ��Ȼ��Ƶõ�������
D.���裺�ý�̿����������ڸ����·�Ӧ���ɴֹ�Ͷ�����̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��Ⱥ����Լ��ֺ���λ�������Ӿ�����
A.Ba(OH)2B.H2SO4C.(NH4)2SO4D.CaF2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ˮ��Һ��1molCl����ClOx��(x=1��2��3��4)������(kJ)��Դ�С��ͼ��ʾ�������й�˵����ȷ���ǣ� ��

A. a��b��c��d��e�У�c���ȶ�
B. b��a+c��Ӧ�Ļ��Ϊ20kJ��mol��1
C. b��a+d��Ӧ���Ȼ�ѧ����ʽΪ3ClO��(aq)=ClO3��(aq)+2Cl��(aq) ��H=+116kJ��mol��1
D. һ���¶��£�Cl2��NaOH��Һ��Ӧ���ɵIJ�����a��b��d����Һ��a��b��d��Ũ��֮�ȿ���Ϊ11��1��2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com