
| A、饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B、向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C、向0.0008 mol?L-1的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液,则先产生AgCl沉淀 |
| c3(Ag+) |
| 2 |
| c3(Ag+) |
| 2 |
| Ksp(Ag2CrO4) |
| c2(Ag+) |
| 1×10-12 |
| (0.0002)2 |
| Ksp(AgCl) |
| c(Cl-) |
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、金刚石属于金属单质 |
| B、制造过程中Na是还原剂 |
| C、CCl4是一种化合物 |
| D、这个反应是置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有丁达尔效应 |
| B、浑浊不透明 |
| C、不能透过滤纸 |
| D、所得分散系不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LSO3中含有氧原子数目为0.3NA |
| B、0.1 molCl2全部溶于水后转移电子数目为0.1 NA |
| C、只有在标准状况下,NA个 O2所占的体积才是22.4L |
| D、6.0g甲酸甲酯和正丙醇的混合物中含甲基数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:向盛有固体K2Cr2O7的A、B两试管中分别加入一定量的稀硫酸 | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| OH- |
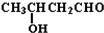
| -H2O |
| △ |
 +CO
+CO| AlCl3,HCl |
| △ |
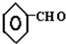
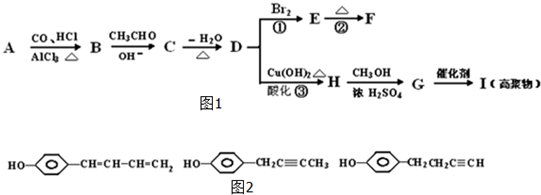
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com