
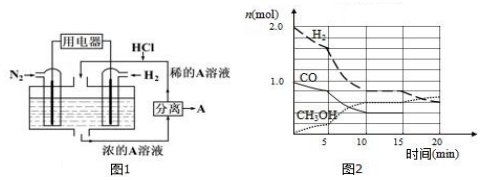
分析 (1)电池中氢气失电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵;
(2)10min时反应到达平衡,平衡时CO为0.4mol、甲醇为0.6mol、氢气为0.8mol,根据v=$\frac{△c}{△t}$计算v(CO),根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数.
解答 解:(1)该电池的本质反应是合成氨反应,电池中氢气失电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,则正极反应式为N2+8H++6e-=2NH4+,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵溶液,
故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)10min时反应到达平衡,平衡时CO为0.4mol、甲醇为0.6mol、氢气为0.8mol,
则v(CO)=$\frac{\frac{1mol-0.4mol}{2L}}{10min}$=0.03mol/(L.min),平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{0.6}{2}}{\frac{0.4}{2}×(\frac{0.8}{2})^{2}}$=9.375,
故答案为:0.03mol/(L.min);9.375.
点评 本题考查化学平衡计算、原电池等,为高频考点,侧重考查学生的分析能力和计算能力,注意把握化学平衡的计算以及图象的分析,把握原电池的工作原理,难度中等.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
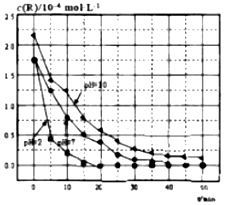
| A. | 对比pH=7和pH=10的曲线,在同一时刻,能说明R的起始浓度越大,降解速率越大 | |
| B. | 对比pH=2和pH=7的曲线,说明溶液酸性越强,R的降解速率越大 | |
| C. | 在0~20min之间,pH=2时R的平均降解速率为0.0875×10-4mol•L-1•min-1 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
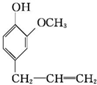 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: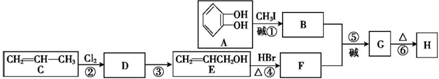
 (X代表卤素原子);
(X代表卤素原子);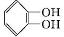 +CH3I$\stackrel{碱}{→}$
+CH3I$\stackrel{碱}{→}$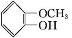 +HI.
+HI.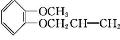 .
.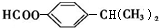 (任写一种).
(任写一种).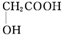 )及化合物A为原料经如下步骤可合成邻苯氧乙酸酚酯:
)及化合物A为原料经如下步骤可合成邻苯氧乙酸酚酯: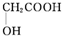 $\stackrel{反应条件Ⅰ}{→}$G$→_{②A/碱}^{①Na_{2}CO_{3}溶液}$H$\stackrel{酸化}{→}$$\stackrel{反应条件Ⅱ}{→}$
$\stackrel{反应条件Ⅰ}{→}$G$→_{②A/碱}^{①Na_{2}CO_{3}溶液}$H$\stackrel{酸化}{→}$$\stackrel{反应条件Ⅱ}{→}$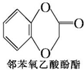
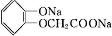 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废弃的聚乙烯泡沫直接填埋 | B. | 焚烧废旧电脑器件回收金属 | ||
| C. | 生活垃圾直接作为饲料喂养家畜 | D. | 废弃农作物发酵制备沼气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 部分信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 |
| Z | Z元素的最高正化合价与最低负化合价的代数和等于6 |
| W | 地壳中含量最多的金属元素 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br- | |
| B. | 水电离出的c(H+)=10-13mol•L-1的溶液中:Fe3+、K+、CO32-、SO32- | |
| C. | 室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液中:Al3+、Na+、SiO32-、HCO3- | |
| D. | 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃、l0IKPa下,NA个C18O2分子的质量为48g | |
| B. | 标准状况下,22.4L HF中含有的电子数为10NA | |
| C. | 1mol白磷(P4)分子中所含化学键的数目为4NA | |
| D. | 1L0.1 mol/L的NaClO水溶液中含有的氧原子数为0.l NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com