
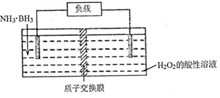
 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )| A. | 负极附近溶液的PH增大 | |
| B. | 正极的反应式为:H2O2+2H++2e-=2H2O | |
| C. | 电池工作时,BO2-通过质子交换膜向正极移动 | |
| D. | 消耗3.lg氨硼烷,理论上转移0.2mol电子 |
分析 以氨硼烷(NH3•BH3)电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O可知,左侧NH3•BH3为负极失电子发生氧化反应,电极反应式为NH3•BH3+2H2O-6e-=NH4BO2+6H+,右侧H2O2为正极得到电子发生还原反应,电极反应式为3H2O2+6H++6e-═6H2O,据此分析.
解答 解:A.NH3•BH3为负极失电子发生氧化反应,电极反应式为NH3•BH3+2H2O-6e-=NH4BO2+6H+,所以负极附近溶液pH减小,故A错误;
B.右侧H2O2为正极得到电子发生还原反应,电极反应式为H2O2+2H++2e-=2H2O,故B正确;
C.放电时,阴离子向负极移动,所以BO2-通过质子交换膜向负极移动,故C错误;
D.负极电极反应式为NH3•BH3+2H2O-6e-=NH4BO2+6H+,则消耗3.lg即0.1mol氨硼烷,理论上转移0.6mol电子,故D错误;
故选B.
点评 本题考查了原电池原理,涉及电极反应式的书写、电极的判断、离子移动方向等知识点,难点是电极反应式的书写,要结合电解质溶液书写,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸的分子模型可表示为 | |
| B. | 糖类、油脂、蛋自质都是高分子化合物 | |
| C. | 乙烯使溴的四氯化碳溶液褪色是因为发生了加成反应 | |
| D. | 炒菜时加酒和醋能使菜味香可口,原因是有酯类物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
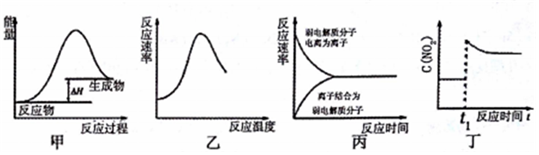
| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(NO2)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验事实 | 理论解释 |
| A | Be原子的第一电离能小于B原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CH4为正四面体形分子 | CH4分子中C为sp3杂化,键角为109°28′ |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点高于HCl | HF分子间能形成氢键,HCl不能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一切物质中都存在化学键 | |
| B. | 含有共价键的物质是共价化合物 | |
| C. | 由非金属元素组成的化合物是共价化合物 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 【系列一】实验 | 溶液X | 实验现象 | |
| 实验Ⅰ | 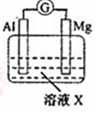 | 1mol/L稀硝酸 | 观察到电流计指针向左偏转. |
| 实验Ⅱ | 6mol/L稀硝酸 | 观察到电流计指针向左偏转,铝片表面产生无色气体,在液面上方变为红棕色 | |
| 实验Ⅲ | 6mol/LNaOH溶液 | 观察到(现象写在答题处). | |
| 实验Ⅳ | 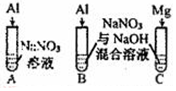 | A、C中均无明显现象,B中有无色气体生成. | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制水闸门常与直流电源的正极相连,可防止其腐蚀 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| D. | 一定温度下,CH3COOH稀溶液中加入少量的冰醋酸,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com