
下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽.断开
为电镀槽.断开![]() ,接通电路后发现
,接通电路后发现![]() 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通![]() 后,使c、d两点短路.
后,使c、d两点短路.
(1)a极为 e极连接的电极材料为
(2)若通电一段时间后,铁上质量增加1.28g,则电源提供的电量为 库仑?(每个电子所带电量为1.6x10-19C,保留两位小数点)
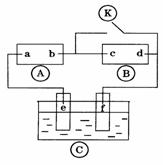 (3)若
(3)若![]() 中两极为石墨电极,电解液为400ml的AgNO3溶液,则e,f两极的电极反应式分别为 ,
中两极为石墨电极,电解液为400ml的AgNO3溶液,则e,f两极的电极反应式分别为 ,
通过和(2)相同的电量后溶液的PH为 (假设电解后溶液体积不变,PH= -lgc(H+) )
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(10分)高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾。下面是实验室制取高锰酸钾的过程:
①称取15g固体KOH和8g固体KClO3,导入坩埚内,混合均匀,小火加热,并用铁棒搅拌。待混合物熔融后,一面搅拌,一面将10gMnO2粉末分批加入。随着反应的进行,熔融物的粘度逐渐增大,此时用力搅拌,待反应物干涸后,再强热5~10min。
②待熔体冷却后,从坩埚内取出,放入250mL烧杯中,用80mL蒸馏水分批浸取,并不断搅拌,加热以促进其溶解。趁热减压过滤浸取液,即可得到墨绿色的K2MnO4溶液。
③将K2MnO4溶液倒入烧杯中,加热至60℃,按如图所示进行电解。阳极是光滑的镍片,卷成圆筒状,阴极为粗铁丝。接通直流电源,高锰酸钾在阳极析出沉于烧杯底部,溶液由墨绿色逐渐转为紫红色,电解1h后,停止通电,取出电极。在冷水中冷却电解液,使结晶完全,用玻璃砂布氏漏斗将晶体抽干,称重,计算产率。
回答下列问题:
(1)步骤①发生的反应方程式为______________________________
(2)步骤①中共熔时要选择__________坩埚(填“铁”、“陶瓷”或“石英”)。
(3)写出步骤③中发生的电极反应式:
阳极____________________________ 阴极________________________
(4)实验中用到抽滤操作,抽滤装置如下图所示,仪器B的名称是___________。抽滤完毕,吸滤瓶内的液体从_____________________倒出。步骤③抽滤时使用玻璃砂布氏漏斗的原因是_________________________________________________
查看答案和解析>>
科目:高中化学 来源:2012届浙江省宁波四中高三第一学期期末考试化学试卷 题型:实验题
(10分)高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾。下面是实验室制取高锰酸钾的过程:
①称取15g固体KOH和8g固体KClO3,导入坩埚内,混合均匀,小火加热,并用铁棒搅拌。待混合物熔融后,一面搅拌,一面将10gMnO2粉末分批加入。随着反应的进行,熔融物的粘度逐渐增大,此时用力搅拌,待反应物干涸后,再强热5~10min。
②待熔体冷却后,从坩埚内取出,放入250mL烧杯中,用80mL蒸馏水分批浸取,并不断搅拌,加热以促进其溶解。趁热减压过滤浸取液,即可得到墨绿色的K2MnO4溶液。
③将K2MnO4溶液倒入烧杯中,加热至60℃,按如图所示进行电解。阳极是光滑的镍片,卷成圆筒状,阴极为粗铁丝。接通直流电源,高锰酸钾在阳极析出沉于烧杯底部,溶液由墨绿色逐渐转为紫红色,电解1h后,停止通电,取出电极。在冷水中冷却电解液,使结晶完全,用玻璃砂布氏漏斗将晶体抽干,称重,计算产率。
回答下列问题:
(1)步骤①发生的反应方程式为______________________________
(2)步骤①中共熔时要选择__________坩埚(填“铁”、“陶瓷”或“石英”)。
(3)写出步骤③中发生的电极反应式:
阳极____________________________ 阴极________________________
(4)实验中用到抽滤操作,抽滤装置如下图所示,仪器B的名称是___________。抽滤完毕,吸滤瓶内的液体从_____________________倒出。步骤③抽滤时使用玻璃砂布氏漏斗的原因是_________________________________________________
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期中考试化学试卷(解析版) 题型:填空题
(9分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

阴离子膜法电解装置如下图所示:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp
(Fe(OH)3) = 4 ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3
沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg =
-0.1 lg
=
-0.1 lg =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
|
离子 |
Fe3+ |
A13+ |
Fe2+ |
Mn2+ |
Mg2+ |
|
开始沉淀的pH |
1.2 |
3.7 |
7.0 |
7.8 |
9.3 |
|
沉淀完全的pH |
3.7 |
4.7 |
9.6 |
9.8 |
10.8 |
加氨水调节溶液的pH等于6,则“滤渣(待处理)”的成分是 (写化学式),滤液中含有的阳离子有H+和 (写符号)。
(4)在浸出液里锰元素只以Mn2+的形式存在,且滤渣A中也无MnO2,请用离子方程式解释原因: 。
(5)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(6)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三第一学期期末考试化学试卷 题型:实验题
(10分)高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾。下面是实验室制取高锰酸钾的过程:

①称取15g固体KOH和8g固体KClO3,导入坩埚内,混合均匀,小火加热,并用铁棒搅拌。待混合物熔融后,一面搅拌,一面将10gMnO2粉末分批加入。随着反应的进行,熔融物的粘度逐渐增大,此时用力搅拌,待反应物干涸后,再强热5~10min。
②待熔体冷却后,从坩埚内取出,放入250mL烧杯中,用80mL蒸馏水分批浸取,并不断搅拌,加热以促进其溶解。趁热减压过滤浸取液,即可得到墨绿色的K2MnO4溶液。
③将K2MnO4溶液倒入烧杯中,加热至60℃,按如图所示进行电解。阳极是光滑的镍片,卷成圆筒状,阴极为粗铁丝。接通直流电源,高锰酸钾在阳极析出沉于烧杯底部,溶液由墨绿色逐渐转为紫红色,电解1h后,停止通电,取出电极。在冷水中冷却电解液,使结晶完全,用玻璃砂布氏漏斗将晶体抽干,称重,计算产率。
回答下列问题:
(1)步骤①发生的反应方程式为______________________________
(2)步骤①中共熔时要选择__________坩埚(填“铁”、“陶瓷”或“石英”)。
(3)写出步骤③中发生的电极反应式:
阳极____________________________ 阴极________________________
(4)实验中用到抽滤操作,抽滤装置如下图所示,仪器B的名称是___________。抽滤完毕,吸滤瓶内的液体从_____________________倒出。步骤③抽滤时使用玻璃砂布氏漏斗的原因是_________________________________________________

查看答案和解析>>
科目:高中化学 来源:湖南省模拟题 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com