
【题目】下列过程不属于化学变化的是
A.煤的干馏 B.石油的分馏 C.石油的裂解 D.蔗糖的水解
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用。它与二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装置:

(l)A中制取CO2的装置,应从下列图①、②、③中选哪个图:_____。

B装置的作用是________, C装置内可能出现的现象是________。为了检验E中收集到的气体,在取出集气瓶后,用________的木条伸入集气瓶内,木条会出现________。
(2)若E中的石灰水出现轻微白色浑浊,请说明原因:________。
(3)若D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?________。
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值______(答大或小),相差约________mL(取整数值,所用数据均在标准状况下测定),这是由于________。
(5)你认为上述A~E的实验装置中,E部分是否安全、合理?E是否需要改为下列四项中的哪一项:________。(用甲、乙、丙、丁回答)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是( )
A.在氢氧化钡溶液中加入过量小苏打:Ba2++2OH﹣+2HCO3﹣=BaCO3↓+CO32﹣+2H2O
B.硝酸银与铜:Cu+2Ag+=Cu2++2Ag
C.制氢氧化铁胶体:Fe3++3H2O=Fe(OH)3↓+3H+
D.标准状况下2.24LCO2通入1mol/L50mLCa(OH)2溶液中:CO2+OH﹣=HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积固定不变的密闭容器中进行可逆反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH > 0,一段时间后,达到化学平衡状态。下列叙述正确的是
Z(g)+W(s) ΔH > 0,一段时间后,达到化学平衡状态。下列叙述正确的是
A.加入少量W,逆反应速率增大
B.通入一定量氦气,压强增大,平衡向正反应方向移动
C.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
D.降低温度,正反应速率减小,逆反应速率也减小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.H2O2属于共价化合物,分子中只含有共价键
B.Na2O2属于离子化合物,该物质中只含有离子键
C.分子间作用力CH4<SiH4,所以CH4沸点高
D.CO2中碳原子与氧原子间存在共价键,所以干冰为原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知下列变化过程中,有一个RxO72﹣离子反应时,反应就转移6个电子,
RxO72﹣+ Fe2++ H+= R3++ Fe3++ H2O
(1)X值;
(2)配平上述离子方程式(直接在括号内写出).
(3)氧化剂;还原产物 .
(4)请画出该反应的单线桥,标出电子转移的方向和数目.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:CO2(g)+C(s)![]() 2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加C,平衡_________(填“正向移动”、“逆向移动”或“不移动”,下同),c(CO2)__________(填“增大”、“减小”或“不变”,下同)。
(2)缩小反应容器的容积,保持温度不变,则平衡__________________,c(CO2)__________________。
(3)保持反应容器的容积和温度不变,通入N2,则平衡_________________,c(CO2)__________________。
(4)保持反应容器的容积不变,升高温度,则平衡__________________,c(CO)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“雾霾”成为人们越来越关心的环境问题。雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质。请回答下列问题:
(1)汽车尾气是雾霾形成的原因之一。尾气治理可用汽油中挥发出来的烃类物质(CxHy)催化还原尾气中的NO气体,该过程的化学方程式为___________________。
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180.5 kJ·mol-1
2NO(g) ΔH1=+180.5 kJ·mol-1
②2CO(g)![]() 2C(s)+O2(g) ΔH2=+221 kJ·mol-1
2C(s)+O2(g) ΔH2=+221 kJ·mol-1
③C(s)+O2(g)![]() CO2(g) ΔH3=-393.5 kJ·mol-1
CO2(g) ΔH3=-393.5 kJ·mol-1
则ΔH=_____________。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
①a表示_____离子交换膜(填“阴”或“阳”)。A~E分别代表生产中的原料或产品,其中C为硫酸,则A表示_________,E表示___________。
②阳极的电极反应式为___________________________。
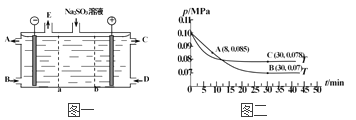
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为____________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)______vA(逆)(填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com