
 化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.分析 (1)硅酸盐由盐的书写改写为氧化物的形式为:活泼金属氧化物•较活泼金属氧化物•二氧化硅•水的顺序书写;氯气与氢氧化钠反应制备漂白液;
(2)硫酸亚铁易被氧气氧化;酸性条件下,亚铁离子与氧气反应生成铁离子和水;高锰酸钾与亚铁离子反应,高锰酸钾褪色;
(3)从经济角度分析,制取等量的硫酸铜时,所用的原料最少且最便宜的成本最低;从环境保护的角度出发,在制取硫酸铜时最好不要对环境造成污染;
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物;
(5)CuSO4溶液能用作P4中毒的解毒剂,反应生成磷酸和铜;
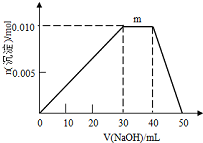
(6)①N点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O;
②根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42-)、n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量.
解答 解:(1)硅酸盐由盐的书写改写为氧化物的形式为:活泼金属氧化物•较活泼金属氧化物•二氧化硅•水的顺序书写,则Na2CaSi6O14,以氧化物形式可表示为Na2O•CaO•6SiO2;氯气与氢氧化钠反应制备漂白液,氯气反应生成NaClO和NaCl、水;
故答案为:Na2O•CaO•6SiO2;NaClO和NaCl;
(2)亚铁易被氧化,当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是防止Fe2+被氧化;酸性条件下,亚铁离子与氧气反应生成铁离子和水,其反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;高锰酸钾与亚铁离子反应,高锰酸钾褪色,其反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
故答案为:防止Fe2+被氧化;4Fe2++O2+4H+=4Fe3++2H2O;MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
(3)A.铜和浓硫酸反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2 ↑+2H2O,该反应中产生有毒气体二氧化硫,所以对环境有污染,不符合“绿色化学”理念,且硫酸的利用率不高,故A错误.
B.铜和稀硫酸不发生反应,不能制得硫酸铜,故B错误.
C.氧化铜和硫酸反应的方程式为:CuO+H2SO4=CuSO4+H2O,没有污染物,且硫酸的利用率100%,符合“绿色化学”和“降低成本”理念,故C正确.
D.铜与Fe(SO4)3溶液反应反应方程式为:Cu+2Fe(SO4)3=CuCl2+2FeCl2,该反应虽有硝酸铜生成,但同时生成氯化铜,不能得到纯净硫酸铜,故D错误.
故答案为:C;
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应化学方程式:2MgO+C+2Cl2=CO2+2MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O,Cl2+2NaOH=NaCl+NaClO+H2O,产物为NaCl,NaClO,Na2CO3 ;
故答案为:2MgO+C+2Cl2=CO2+2MgCl2;NaCl,NaClO,Na2CO3 ;
(5)CuSO4溶液能用作P4中毒的解毒剂,反应生成磷酸和铜,该反应的化学方程式是:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4,
故答案为:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4;
(6)①N点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O,离子方程式为:NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O;
②10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
点评 本题考查核了硅酸盐、氧化还原反应、元素化合物的性质、物质的制备工艺、化学图象及化学计算,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NF3分子呈三角锥形 | |
| B. | NF3分子是极性分子 | |
| C. | NF3与NH3晶体类型相同 | |
| D. | 上述反应的反应物和生成物均属于共价分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbCO3 | B. | SnCO3•Sn(OH)2 | C. | 2PbCO3•Pb(OH)2 | D. | (CH3COO)2Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有的共价化合物在液态时也能导电 | |
| B. | 含有离子键的化合物中,也可能还含有共价键 | |
| C. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵固体 | B. | 硫酸 | C. | NaOH固体 | D. | 大量水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 一种烃在足量的氧气中燃烧并通过碱石灰,减少的体积就是生成水蒸气的体积 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4,若体积减少,则y>4,否则y<4 | |
| D. | 相同质量的烃,完全燃烧,消耗的O2越多,则烃中氢元素的百分含量越高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com