
【题目】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
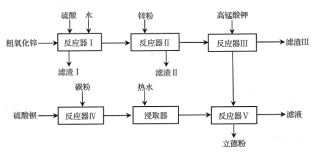
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___。
(2)加入锌粉的主要目的是___(用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___,反应的化学方程式为__(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
【答案】反应中产生氢气,达一定浓度后易爆炸,出现危险,需要通风 Zn+Cu2+= Zn2++Cu b MnO2和Fe(OH)3 避免产生CO等有毒气体 尾气中含有的SO2等有毒气体 ZnSO4、BaS、Na2S 4 ZnSO4 + BaS + 3 Na2S = BaSO4·4ZnS + 3 Na2SO4
【解析】
分析流程中的相关反应:反应器Ⅰ中粗氧化锌中所含Zn、CuO、FeO与硫酸反应,不溶性杂质以滤渣Ⅰ的形式过滤分离;反应器Ⅱ中用Zn置换溶液中Cu2+;反应器Ⅲ中用KMnO4氧化Fe2+,同时控制pH,在弱酸性、弱碱性环境中,产生MnO2和Fe(OH)3沉淀得到净化的ZnSO4溶液;反应器Ⅳ中 BaSO4 + 2C = BaS + 2CO2制备BaS;反应器Ⅴ用ZnSO4和BaS共沉淀制备立德粉。
⑴反应器Ⅰ中Zn与硫酸反应产生氢气,保持强制通风,避免氢气浓度过大而易发生爆炸,出现危险,故答案为反应中产生氢气,达一定浓度后易爆炸,出现危险,需要通风。
⑵反应器Ⅱ中用Zn置换溶液中Cu2+,其离子方程式为Cu2+,Zn+Cu2+= Zn2++Cu,故答案为Zn+Cu2+= Zn2++Cu。
⑶反应器Ⅲ除Fe2+,将亚铁离子氧化为铁离子以便除去,同时在弱酸性、弱碱性环境中KMnO4还原为MnO2,以滤渣形式分离,因此在弱酸性环境来氧化亚铁离子,利用铁离子水解变为沉淀,故答案为b;MnO2和Fe(OH)3。
4反应器Ⅳ中BaSO4 + 2C = BaS + 2CO2,BaSO4 + 4C = BaS + 4CO,投料比要大于1:2,避免产生CO等有毒气体;生产过程中会有少量氧气进入反应器Ⅳ,将BaS氧化产生SO2等有毒气体,因此有毒气体要除掉需用碱液吸收,故答案为避免产生CO等有毒气体;尾气中含有的SO2等有毒气体。
⑸已知BaSO4的相对分子质量为233,ZnS的相对分子质量为97,ZnS含量为29.4%,立德粉为BaSO4·ZnS;ZnS含量为62.5%,立德粉(BaSO4· 4ZnS),因此需要4mol ZnSO4和1mol BaS反应生成BaSO4·4ZnS,还需要3mol硫离子和将3mol硫酸根与另外的离子结合,因此还需要3mol Na2S参与反应,反应的化学方程式为:4 ZnSO4 + BaS + 3 Na2S = BaSO4·4ZnS + 3 Na2SO4,故答案为ZnSO4、BaS、Na2S;4 ZnSO4 + BaS + 3 Na2S = BaSO4·4ZnS + 3 Na2SO4。


科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质。
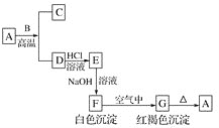
(1)写出下列物质的化学式:A________、E________、F________、G________。
(2)按要求写方程式:
①A+B→C+D的化学方程式:_________________________________;
②F→G的化学方程式:________________________________________________;
③E→F的离子方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.己烷有4种同分异构体,它们的熔点、沸点各不相同
B.在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
C.油脂皂化反应得到高级脂肪酸盐与甘油
D.聚合物 可由单体CH3CH=CH2和CH2=CH2加聚制得
可由单体CH3CH=CH2和CH2=CH2加聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关同分异构体的说法,错误的是
A.若两种有机物互为同分异构体,则二者的分子式相同
B.分子式为C5H12的的同分异构体有3种
C.1-丁烯、2-丁烯均存在顺反异构
D.同分异构现象的广泛存在是造成有机物种类繁多的重要原因之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略)
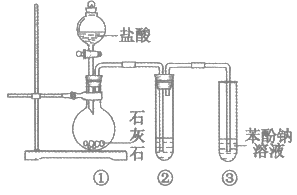
A. 打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊
B. ②中试剂为饱和NaHCO3溶液
C. ③中发生反应的化学方程式是![]()
D. 苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性
查看答案和解析>>
科目:高中化学 来源: 题型:
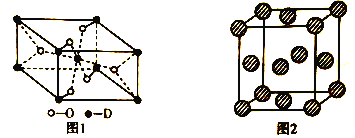
【题目】A、B、C、D、E代表原子序数依次增大的前四周期元素,其中A和C为同一主族,C常用于制作半导体器件和集成电路,B的简单氢化物的水溶液呈碱性,E元素的正三价离子的3d亚层为半充满,D被称为“未来金属”,其重量轻、强度高、耐腐蚀,其在周期表中位于第4周期、第ⅣB族。
(1)A、B、C三种元素的第一电离能由小到大的顺序为______________________,电负性由小到大的顺序为____________________。
(2)B的简单氢化物易液化的原因是_______________;BH4+中B原子的杂化方式为___________,空间构型为__________________。
(3)E元素基态原子的电子排布式为____________________________________。
(4)B和C形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于__________________晶体。
(5)D有多种氧化物,其中一种氧化物的晶胞结构如图1所示,则该晶体中D的配位数为__________________;图2为E的一种面心立方晶胞结构,若晶胞的边长为acm,NA表示阿伏加德罗常数的值,则E的密度为__________________g·cm-3(用含a和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体A在一定条件下加热分解,产物都是气体。分解的方程式为:2A=B↑+2C↑+2D↑。测得生成的混合气体对H2的相对密度为d,则A的相对分子质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,①pH=3的醋酸和②0.01mol·L-1NaOH溶液两种溶液中,由水电离产生的氢离子浓度之比(①∶②)是( )
A.1∶10B.1∶4C.10∶1D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的气体,并靠近火焰点燃。
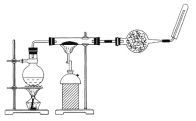
(1)观察到的现象是_________________________________,有关反应的化学方程式是________________________________。
(2)干燥管内可装入的试剂是____________________,其作用是______________________。
(3)实验开始时应先点燃________,实验结束时,应先熄灭________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com