
| A. | n/16 | B. | n | C. | 16n | D. | 32n |
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | (1)(4)(3)(2) | B. | (4)(1)(3)(2) | C. | (4)(2)(1)(3) | D. | (1)(3)(4)(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
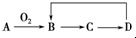 ,其中D是最高价氧化物对应的水化物.那么A可能是( )
,其中D是最高价氧化物对应的水化物.那么A可能是( )| A. | 只有①④⑤ | B. | 只有①②③ | C. | 只有①⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4gNH3中含N-H键数目为0.2NA | |
| B. | 标准状况下,体积相同的两种气体的分子数一定相同 | |
| C. | 标准状况下,22.4 L甲醇中含有的氧原子数目为1.0NA | |
| D. | 1 L 0.1 mol•L-1的Fe2(SO4)3溶液中,Fe3+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性高锰酸钾和草酸的反应中,加硫酸锰可大大加快反应速率 | |
| B. | 硫代硫酸钠和硫酸的反应中有硫和二氧化硫产生 | |
| C. | FeCl3和CuSO4都可以做过氧化氢分解的催化剂,且催化效果一样 | |
| D. | H2O2的分解的方程式:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com