
| A. | Na+、Ca2+、Cl-、AlO2- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | NH4+.、Mg2+、SO42-、Cl- |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,pH=0的溶液中存在大量氢离子,
A.偏铝酸根离子与氢离子反应;
B.氢氧根离子与氢离子反应生成水;
C.铜离子为有色离子;
D.四种离子之间不反应,都不与氢离子反应,且为无色溶液.
解答 解:无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,pH=0的溶液为酸性溶液,溶液中存在大量氢离子,
A.AlO2-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故A错误;
B.OH-与氢离子反应,在溶液中不能大量共存,故B错误;
C.Cu2+为有色离子,在溶液中不能大量共存,故C错误;
D.NH4+、Mg2+、SO42-、Cl-之间不发生反应,都是无色离子,都不与氢离子反应,在溶液中可以大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
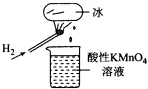
| A. | 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 | |
| B. | 该条件下H2燃烧的产物中可能含有一定量的H2O2、HO2等 | |
| C. | 将烧杯中溶液换成KI淀粉溶液也能验证生成物具有还原性 | |
| D. | 酸性FeSO4溶液中加入双氧水的离子反应为:2Fe 2++H2O2+2H+=2Fe3++2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应.某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验.
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应.某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验.| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | Fe | NaHCO3 | Si | Fe2O3 |
| 用途 | 可运输浓硫酸 | 发酵 | 光导纤维 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
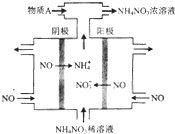 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
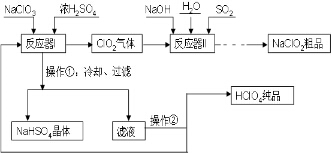 工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应时,1 mol Na2O2转移1 mol电子 | |
| B. | 78gNa2O2含有阴、阳离子总数是4NA | |
| C. | 1mo1•L-1的AlC13溶液中,C1-离子的数目为3 NA | |
| D. | 5.6 g铁与足量盐酸反应转移的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2molA(g)和1molB(g)所具有的总能量小于2mol C(g)所具有的能量 | |
| B. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| C. | 将2molA(g)和1molB(g)置于一密闭容器中充分反应后,放出热量为QkJ | |
| D. | 如将一定量A(g)和B(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2molA(g)被消耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N有相同的中子数 | |
| B. | 13C一种同位素14C具有放射性,14C不可用于考古断代,推算出文物的年代 | |
| C. | 一个15N的质量约为2.5×10-25 kg | |
| D. | 15N的核外电子数与中子数不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com