
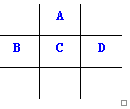
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: .
.分析 A、B、C、D、E五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl;1molE单质与足量酸作用,在标准状况下能产生33.6LH2,设E的化合价为y,根据电子转移守恒:1mol×y=$\frac{33.6L}{22.4L/mol}$×2×1,解得:y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D、E五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl;1molE单质与足量酸作用,在标准状况下能产生33.6LH2,设E的化合价为y,根据电子转移守恒:1mol×y=$\frac{33.6L}{22.4L/mol}$×2×1,解得:y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,
(1)根据分析可知E为铝元素;A为O元素,其离子为O2-,氧离子的核电荷数为8,核外电子总数为10,其离子结构示意图为: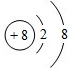
故答案为:铝;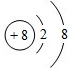 ;
;
(2)A与E形成的化合物为氧化铝,化学式为Al2O3,氧化铝能够与强酸和强碱溶液反应,属于两性氧化物,
故答案为:Al2O3;两性氧化物;
(3)D为Cl、E为Al,二者形成的化合物为氯化铝,向氯化铝溶液中滴入烧碱溶液,开始时生成白色沉淀氢氧化铝,当氢氧化钠过量时,氢氧化铝沉淀逐渐溶解,之至沉淀完全消失,
故答案为:先有白色沉淀生成,后沉淀逐渐减少至消失.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,元素的推断是解答本题的关键,注意理解同主族元素质子数关系,注意利用电子守恒确定元素化合价,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 | |
| B. | 除去苯中少量的苯酚:加溴水,振荡,过滤除去沉淀 | |
| C. | 只用溴水就可以将苯、四氯化碳、酒精、已烯、苯酚这五种物质区别开来 | |
| D. | 溴乙烷水解后的溶液中直接加入AgNO3溶液用来检验溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}、点燃}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | H2SO4$\stackrel{Cu}{→}$SO2$\stackrel{BaCl_{2}溶液}{→}$BaSO3 | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl}{→}$H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=[Al(OH)4]-+4 NH4+ | |
| B. | 澄清石灰水与小苏打溶液混合:Ca2++CO32-=CaCO3↓ | |
| C. | Na[Al(OH)4]溶液中加入过量盐酸:AlO2-+H++H2O=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
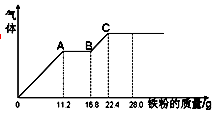 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶19.2g(己知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.回答下列问题:
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶19.2g(己知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| A. | Na2SO3溶液中c(H+)<c (OH-) | |
| B. | Na2SO3溶液中c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)>c(H+) | |
| C. | 当吸收液呈中性时,c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)=c(H+) | |
| D. | 当吸收液呈中性时,c(Na+)>c (HSO3-)+c (SO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com