
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用非常广泛。
(1)Co2+基态核外电子排布式为_________。
(2)制备[Co(H2O)6]2+反应为(NH4)2[Co(SCN)4] +6H2O= [Co(H2O)6(SCN)2+2NH4SCN。
①配合物[Co(H2O)6]2+中与Co2+形成配位键的原子是________(填元素符号);SCN-的空间构型为________(用文字描述)。
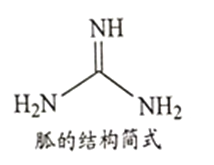
②NH4SCN在180-190℃分解并制得胍(结构简式如图所示),胍分子中氮原子杂化轨道类型为_________; 1mol 胍中含σ键数目为________。
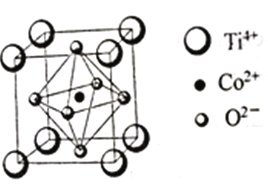
(3)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,则晶体中与每个O2-紧邻的O2-有______个(填数字)。
乙酸异戊酯是无色透明的液体,沸点142℃,可用作食品香料。合成方法如下:
CH3COOH+HO(CH2)2CH(CH3)CH3 ![]() CH3COO(CH2)2CH(CH3)CH3+H2O
CH3COO(CH2)2CH(CH3)CH3+H2O
步骤1.称取26.4g (0.3mol) 的异戊醇和21.6g (0.36mol) 乙酸,置于三口烧瓶中,加入适量FeCl3·6H2O 和几粒沸石。
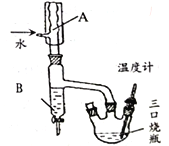
步骤2.装上温度计和仪器B (如右图),回流1h。
步骤3.稍冷后将仪器B 改为蒸馏装置,收集粗馏份。
步骤4.反应结束后分别用饱和食盐水、碳酸氢钠溶液和水分别洗涤、分液。
步骤5.加入2g 无水MgSO4,进一步操作得到乙酸异戊酯。
(1)图中仪器A名称为______,仪器B 的作用是_______
(2)步骤1控制投料比n(乙酸)/n(异戊醇)=1.2,其目的是__________
(3)步骤4用“碳酸氢钠溶液”洗涤的目的是_______; 分液时用到的主要玻璃仪器是______ (写名称)。
(4)步骤5 经MgSO4干燥后,_________得到乙酸异戊酯。
【答案】 1s22s22p63s3p63d7 或[Ar]3d7 O 直线形 sp2和sp3 8mol 8 球形冷凝管 及时分离出反应生成的水 提高异戊醇的转化率 除去过量的乙酸 分液漏斗 蒸馏,收集约142℃的馏分
【解析】(1)27号元素钴,Co2+基态核外电子排布式为1s22s22p63s3p63d7 或[Ar]3d7;(2)①H2O的O原子提供孤电子对,钴离子提供空轨道,配合物[Co(H2O)6]2+中与Co2+形成配位键的原子是O元素;SCN-的空间构型为与CO2是等电子体,为直线型;②胍分子中氮原子形成三个单键的杂化轨道类型为SP3杂化,形成一个双键的杂化轨道类型为SP2杂化,1mol 胍中含σ键数目为8mol ;(3)观察最上面的平面的中心有一个O2-,其上下两个平面中分别有四个O2-,晶体中与每个O2-紧邻的O2-有8个。
(1)图中仪器A冷凝回流末反应的反应物,A名称为球形冷凝管,仪器B 的作用是及时分离出反应生成的水;(2)步骤1控制投料比n(乙酸)/n(异戊醇)=1.2,乙酸过量,增大乙酸的浓度,其目的是提高异戊醇的转化率;(3)步骤4用“碳酸氢钠溶液”洗涤的目的是除去过量的乙酸,分液时用到的主要玻璃仪器是分液漏斗;(4)步骤5 经MgSO4干燥后,蒸馏,收集约142℃的馏分,得到乙酸异戊酯。


科目:高中化学 来源: 题型:
【题目】下列反应中不属于氧化还原反应的是( )
A.3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O
B.3Cl2+6KOH=5KCl+KClO3+3H2O
C.3CCl4+K2Cr2O7=2CrO2C12+3COCl2+2KCl
D.2KMnO4 ![]() ?K2MnO4+MnO2+O2↑
?K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2LNaCl、MgCl2的混合溶液中,部分离子浓度大小如图所示,回答下列问题: 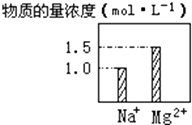
(1)该混合溶液中,Na+的物质的量为mol,MgCl2的物质的量为mol,Cl﹣的物质的量为mol.
(2)该混合溶液中含溶质的总质量为g.
(3)将该混合溶液加水稀释至体积为 1L,稀释后溶液中Cl﹣的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在烷烃分子中,每增加一个碳原子,每摩尔该烷烃完全燃烧需要多消耗氧气( )
A. 1 mol B. 1.5 mol C. 2 mol D. 2.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分數) 与pH的关系如下图所示。

下列叙述正确的是
A. 新制的pH=1的氯水中,c(C13-)>c(HClO)>c(H+)
B. 新制氯水中持续通入SO2,pH不断变小,溶液颜色不断加深
C. 25℃时,HClO![]() H++ClO-的电离常数Ka的对数值为lgKa=-7.54
H++ClO-的电离常数Ka的对数值为lgKa=-7.54
D. pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为HClO+OH-=ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由四原子分子构成,它的摩尔质量为M gmol﹣1 , 则:
(1)该气体的物质的量为mol.
(2)该气体中所含的原子总数为个.
(3)该气体在标准状况下的体积为L.
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2·12H2O (铵明矾) 可用作泡沫灭火器的内留剂、石油脱色剂等。用氧化铁和铝粉等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验步骤如下:
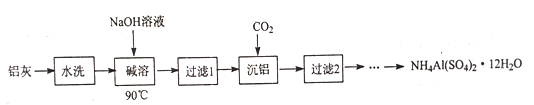
(1) 铝灰用“水洗”的目的是______碱溶时,需在约90℃条件下进行,适宜的加热方式为_____。
(2)“过滤1”所得滤渣主要成分为_________。
(3)用下图左边装置制备CO2时,适宜的药品A 为________、B 为__________;“沉铝”时,通入过量CO2 发生反应的离子方程式为________。
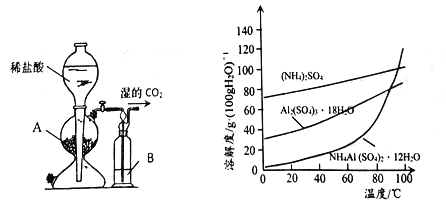
(4)请设计从“过滤2”所得滤渣制取铵明矾的实验方案: 称取一定质量“过滤2”的滤渣,放入烧杯中,____,静置,过滤、洗涤、晾干,得到NH4Al(SO4)2·12H2O [实验中须使用到3mol/L硫酸、(NH4)2SO4、蒸馏水、氨水、pH 试纸; 已知: NH4Al(SO4)2饱和溶液的pH约为1.5,几种物质的溶解度曲线见右上图]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】性能各异的各种材料的广泛应用大大提高了人们的生活水平。回答问题:
(1)家庭中“钢精锅”是由铝合金做成的,在烧菜时能否放大量醋炖煮?______。(填能或否)
(2)下列关于铁制品保护措施的说法中不正确的有___________(填序号)
A.在自行车钢圈上镀上一层金属铬,摩擦部位加上润滑油
B.相同条件下,镀层破损时,马口铁(表层镀锡)比白铁(表层镀锌)更耐用
C.在海轮的外壳上常焊有锌块,且定期更新
D.将不锈钢制成刀具和餐具,有的刀具还需进行烤蓝处理
(3)硅酸盐产品在生活中使用广泛,下列不是硅酸盐产品的是_______________。
A.水泥 B.陶瓷 C.玻璃 D.塑料
(4)钢筋混凝土是重要的建筑材料,钢筋混凝土______ (填“是”或“不是”)复合材料。
(5)生产玻璃时,石灰石与石英反应的化学方程式为______________________________。
(6)SiC是一种新型陶瓷,工业上用石英砂与焦炭高温条件下生成SiC的同时生成CO,该反应的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( ) 
A.物质的量之比为3:2
B.质量之比为2:3
C.摩尔质量之比为2:3
D.反应速率之比为3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com