
| A. | 利用焰色反应可以检验某些金属元素 | |
| B. | C元素和S元素在自然界中既有游离态,又有化合态 | |
| C. | SO2和Na2O2都能使紫色石蕊试液褪色,但漂白原理不同 | |
| D. | 新型陶瓷,玻璃,水泥不都是硅酸盐材料 |
分析 A.不同金属焰色反应不同,利用焰色反应,可以根据火焰的颜色鉴别金属元素的存在与否;
B.碳元素在自然界中有单质碳为游离态碳元素,也含化合物如碳酸盐、甲烷等化合态碳元素,硫元素的游离态为硫单质,化合态为化合物存在形式;
C.Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成无色不稳定的物质,但二氧化硫通入石蕊试液中变红色;
D.硅酸盐指的是硅、氧与其它化学元素(主要是铝、铁、钙、镁、钾、钠等)结合而成的化合物的总称.
解答 解:A.不同金属焰色反应不同,焰色反应能用来检验某些金属元素的存在,故A正确;
B.碳元素在自然界中既有游离态如煤炭,又有化合态如甲烷等含碳的化合物,S元素在自然界中既有游离态如火山口处存在硫单质,又有化合态如硫酸盐等,故B正确;
C.Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成无色不稳定的物质表现出选择性漂白性,二者漂白原理不同,且二氧化硫通入石蕊试液中只变红色不褪色,故C错误;
D.水泥、玻璃、陶瓷都是硅酸盐产品,是硅酸盐材料,新型陶瓷不是硅酸盐产品,故D正确;
故选C.
点评 本题考查了金属焰色反应,硫、碳及其化合物性质,注意二氧化硫的漂白性和过氧化钠的漂白性区别,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ•mol-1 | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的H2SO4溶液中含有H+的数目为0.2NA | |
| B. | 过氧化钠与水反应时,生成0.1molO2转移电子0.2NA | |
| C. | 1.0L 1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| D. | 3.36LCO2和O2的混合气体所含的氧原子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图:烧瓶中充满a气体,滴管和烧杯中盛放足量b溶液,将滴管中溶液挤入烧瓶,打开止水夹f,能形成喷泉的是( )
如图:烧瓶中充满a气体,滴管和烧杯中盛放足量b溶液,将滴管中溶液挤入烧瓶,打开止水夹f,能形成喷泉的是( )| A. | a是Cl2,b是饱和NaCl溶液 | B. | a是NO,b是H2O | ||
| C. | a是CO2,b是饱和NaHCO3溶液 | D. | a是HCl,b是AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
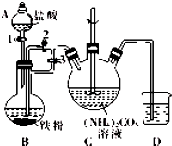 乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,能溶于水,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,能溶于水,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va=Vb时:c(CH3COO-)=c(K+) | |
| B. | Va<Vb时:c(CH3COOH)+c(H+)=c(OH-) | |
| C. | Va>Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) | |
| D. | Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度为0.1 mol/L CH3COOH与0.1 mol/L CH3COONa混合后溶液呈弱酸性,则c(CH3COOH>c(Na+)>c(CH3COO-) | |
| B. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ | |
| C. | NaHCO3溶液:c(OH-)-c(H+)=c((HCO3-)+2c(H2CO3) | |
| D. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com