
| A£® | “ļµ½»ÆŃ§Ę½ŗāŹ±£¬½«ĶźČ«×Ŗ»ÆĪŖNH3 | |
| B£® | “ļµ½»ÆŃ§Ę½ŗāŹ±£¬N2”¢H2ŗĶNH3µÄĪļÖŹµÄĮæÅضČŅ»¶ØĻąµČ | |
| C£® | “ļµ½»ÆŃ§Ę½ŗāŹ±£¬N2”¢H2ŗĶNH3µÄĪļÖŹµÄĮæÅØ¶Č²»ŌŁ±ä»Æ | |
| D£® | “ļµ½»ÆŃ§Ę½ŗāŹ±£¬Õż·“Ó¦ĖŁĀŹŗĶÄę·“Ó¦ĖŁĀŹ¶¼ĪŖĮć |
·ÖĪö æÉÄę·“Ó¦·“Ó¦Īļ²»ÄÜĶźČ«·“Ó¦£¬“ļµ½Ę½ŗāדĢ¬Ź±£¬ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£ØĶ¬ÖÖĪļÖŹ£©»ņÕżÄę·“Ó¦ĖŁĀŹÖ®±ČµČÓŚĻµŹżÖ®±Č£Ø²»Ķ¬ĪļÖŹ£©£¬Ę½ŗāŹ±ø÷ÖÖĪļÖŹµÄĪļÖŹµÄĮ攢ÅØ¶ČµČ²»ŌŁ·¢Éś±ä»Æ£¬ÓÉ“ĖŃÜÉśµÄŅ»Š©ĪļĄķĮæ²»±ä£¬ŅŌ“Ė·ÖĪö£®
½ā“š ½ā£ŗA”¢æÉÄę·“Ó¦·“Ó¦Īļ²»ÄÜĶźČ«·“Ó¦£¬¹ŹA“ķĪó£»
B”¢·“Ó¦Ę½ŗāŹ±ø÷ĪļÖŹµÄÅØ¶ČŹĒ·ńĻąµČČ”¾öÓŚĘšŹ¼Ź±ø÷ĪļÖŹµÄĮæµÄ¹ŲĻµŗĶ×Ŗ»ÆµÄ³Ģ¶Č£¬N2”¢H2°“1£ŗ3»ģŗĻ£¬»Æѧ¼ĘĮæŹżĪŖ1£ŗ3£¬ĖłŅŌ×Ŗ»ÆĀŹĻąµČ£¬Ę½ŗāŹ±£¬N2”¢H2µÄĪļÖŹµÄĮæÅضČŅ»¶ØĪŖ1£ŗ3£¬¹ŹB“ķĪó£»
C”¢Ėę·“Ó¦½ųŠŠ£¬N2”¢H2ŗĶNH3µÄĪļÖŹµÄĮæÅØ¶Č·¢Éś±ä»Æ£¬N2”¢H2ŗĶNH3µÄĪļÖŹµÄĮæÅØ¶Č²»ŌŁ±ä»Æ£¬ĖµĆ÷µ½“ļĘ½ŗāדĢ¬£¬¹ŹCÕżČ·£»
D”¢æÉÄę·“Ó¦Ź±¶ÆĢ¬Ę½ŗā£¬“ļµ½»ÆŃ§Ę½ŗāŹ±£¬Õż·“Ó¦ŗĶÄę·“Ó¦µÄĖŁĀŹ£¬µ«²»ĪŖĮć£¬¹ŹD“ķĪó£®
¹ŹŃ”£ŗC
µćĘĄ ±¾Ģāæ¼²éĘ½ŗāדĢ¬µÄÅŠ¶Ļ£¬Ń”ŌńÅŠ¶ĻµÄ±ź×¼Ó¦Ėę·“Ó¦½ųŠŠ±ä»Æ£¬µ±øƱź×¼²»ŌŁ±ä»ÆĖµĆ÷µ½“ļĘ½ŗāדĢ¬£®


 ĒįĖɶį¹ŚČ«ÄÜÕĘæŲ¾ķĻµĮŠ“š°ø
ĒįĖɶį¹ŚČ«ÄÜÕĘæŲ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ü¢Ž¢ß | B£® | ¢Ś¢Ū¢Ż | C£® | ¢Ł¢Ś¢Ü¢Ž¢ß | D£® | ¢Ł¢Ś¢Ū¢Ü¢Ž¢ß |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | »ŲŹÕ·ĻĘśµÄŅūĮĻ°ü×°Ö½£¬ÖĘ×÷³É¹«Ō°ÄŚµÄŠŻĻŠ³¤ŅĪ | |
| B£® | “óĮ¦æŖ·¢·įø»µÄĆŗĢæ׏Ō“£¬¼õÉŁ¶ŌŹÆÓĶµÄŅĄĄµ | |
| C£® | ŌŚĪ÷²æŗĶŃŲŗ£µŲĒųŠĖ½Ø·ēĮ¦·¢µēÕ¾£¬½ā¾öÄÜŌ“ĪŹĢā | |
| D£® | ¹ÄĄų¹ŗĀņŠ”ÅÅĮæĘū³µ£¬ĶĘ¹ćµē¶Æ”¢»ģŗĻ¶ÆĮ¦Ęū³µ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
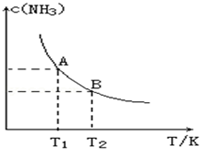 ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«1.00molN2£Øg£©Óė3.00molH2£Øg£©»ģŗĻÓŚŅ»øö10.0LĆܱÕČŻĘ÷ÖŠ£¬ŌŚ²»Ķ¬ĪĀ¶ČĻĀ“ļµ½Ę½ŗāŹ±NH3£Øg£©µÄĘ½ŗāÅضČČēĶ¼ĖłŹ¾£®ĘäÖŠĪĀ¶ČĪŖT1Ź±Ę½ŗā»ģŗĻĘųĢåÖŠ°±ĘųµÄĢå»ż·ÖŹżĪŖ25.0%£®
ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«1.00molN2£Øg£©Óė3.00molH2£Øg£©»ģŗĻÓŚŅ»øö10.0LĆܱÕČŻĘ÷ÖŠ£¬ŌŚ²»Ķ¬ĪĀ¶ČĻĀ“ļµ½Ę½ŗāŹ±NH3£Øg£©µÄĘ½ŗāÅضČČēĶ¼ĖłŹ¾£®ĘäÖŠĪĀ¶ČĪŖT1Ź±Ę½ŗā»ģŗĻĘųĢåÖŠ°±ĘųµÄĢå»ż·ÖŹżĪŖ25.0%£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £Ø1£©ŹµŃéŹŅÅäÖĘ1000mL0.50mol•L-1µÄNa2CO3ČÜŅŗ£¬ŌŚ³£ÓĆŅĒĘ÷֊ӦєÓĆ1000mLµÄČŻĮæĘ棬³ĘĮæŹ±Čō½«·ØĀė·ÅŌŚ×óÅĢ£Ø1gŅŌĻĀÓĆÓĪĀė£©£¬ŌņÅäÖʵÄČÜŅŗµÄĪļÖŹµÄĮæÅØ¶ČµČÓŚ0.50mol•L-1£ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©£®
£Ø1£©ŹµŃéŹŅÅäÖĘ1000mL0.50mol•L-1µÄNa2CO3ČÜŅŗ£¬ŌŚ³£ÓĆŅĒĘ÷֊ӦєÓĆ1000mLµÄČŻĮæĘ棬³ĘĮæŹ±Čō½«·ØĀė·ÅŌŚ×óÅĢ£Ø1gŅŌĻĀÓĆÓĪĀė£©£¬ŌņÅäÖʵÄČÜŅŗµÄĪļÖŹµÄĮæÅØ¶ČµČÓŚ0.50mol•L-1£ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©£®| “ĪŹż±ąŗÅ | “ż²āŃĪĖįĢå»ż£ØmL£© | µĪČėNa2CO3ČÜŅŗĢå»ż£ØmL£© |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C£ØFe3+£©=0.1mol/LµÄČÜŅŗÖŠ£ŗNH4+”¢I-”¢SO42-”¢Cl- | |
| B£® | ¼ÓČėAl·Ū·Å³öH2µÄČÜŅŗÖŠ£ŗNa+”¢K+”¢Fe3+”¢NO3- | |
| C£® | 0.1 mol•L-1AgNO3ČÜŅŗ£ŗH+”¢K+”¢SO42-”¢Br- | |
| D£® | pH=12µÄČÜŅŗÖŠ£ŗK+”¢Cl-”¢CH3COO-”¢CO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | CO32-+H2O?HCO3-+OH-£ŗÓĆČȵēæ¼īČÜŅŗĒåĻ“ÓĶĪŪ | |
| B£® | A13++3H2O?AI£ØOH£©3£Ø½ŗĢ壩+3H+£ŗĆ÷·Æ¾»Ė® | |
| C£® | SnCl2+H2O?Sn£Ø OH£©Cl”ż+HClÅäÖĘĀČ»ÆŃĒĪżČÜŅŗŹ±¼ÓČėĒāŃõ»ÆÄĘČÜŅŗ | |
| D£® | TiCl4+£Øx+2£©H2O£Ø¹żĮ棩?TiO2•xH2O”ż+3H+£ŗÖʱøTiO2ÄÉĆ×·Ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µŚŅ»“ĪŹµŃéĘ½ŗāŹ±·“Ó¦·Å³öµÄČČĮæĪŖ294.9kJ | |
| B£® | Į½“ĪŹµŃéĘ½ŗāŹ±£¬SO2µÄ×Ŗ»ÆĀŹĻąµČ | |
| C£® | µŚ¶ž“ĪŹµŃé“ļĘ½ŗāŹ±SO3µÄĢå»ż·ÖŹż“óÓŚ$\frac{2}{9}$ | |
| D£® | “ļĘ½ŗāŹ±£¬O2±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ0.25mol/£ØL•min£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com