
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
分析 (1)水的电离过程为吸热反应,温度升高,水的电离程度增大,水的离子积增大;
(2)溶液中钠离子浓度是1×10-3 mol/L,如果稀释10倍,则钠离子浓度是1×10-4 mol/L;硫酸钠溶液是显中性的,稀释后溶液中氢离子浓度仍然为10-7mol/L;
(3)混合液的pH=2,酸过量,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{总}}$计算;根据反应后溶液的组成分析各种离子的浓度大小;
(4)硫酸中氢氧根离子是水电离的,硫酸铝中的氢离子是水电离的,根据溶液的pH相同可知:10a-14=10-b.
解答 解:(1)由于水的电离电离过程为吸热反应,温度越高,水的电离程度越大,水的离子积越大,所以若25℃<t1<t2,则KW>1×10-14,
故答案为:>;水的电离吸热,温度升高,水的电离程度增大,所以水的离子积增大;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L,如果稀释10倍,则钠离子浓度是1×10-4 mol/L;但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,
故答案为:1000:1;
(3)混合液的pH=2,酸过量,c(H+)=c(H+)=$\frac{0.1mol/L×{V}_{2}L-0.1mol/L×{V}_{2}L}{{V}_{1}+{V}_{2}}$=0.01,
解之得:V1:V2=9:11;
c(Na+)=0.1×9/(9+11)=0.045mol/L、c(SO42-)=0.05×11/20=0.0275mol/L、c(H+)=0.01mol/L,
硫酸过量溶液显酸性,c 则(H+)>c (OH-),
故溶液中各种离子的浓度由大到小的排列顺序是:c (Na+)>c (SO42-)>c (H+)>c (OH-),
故答案为:9:11;c(Na+)>c(SO42-)>c(H+)>c(OH-);
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,溶液中的氢氧根离子是水电离的,则硫酸中氢离子浓度为c(H+)=10a-14mol/L;
设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-b mol/L,硫酸铝中的氢离子是水电离的,由pH相同可知:10a-14=10-b,则:a+b=14,
故答案为:a+b=14.
点评 本题考查了溶液中离子浓度大小比较以及溶液pH的计算,题目难度中等,该题是高考中的常见题型,属于中等难度的试题;该题的关键是明确溶液中几个重要守恒关系,即:电荷守恒、物料守恒和质子守恒,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
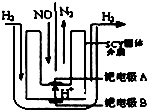 汽车尾气中NOx的消除及无害化处理引起社会广泛关注.
汽车尾气中NOx的消除及无害化处理引起社会广泛关注.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)将一定量固体A置于一个容器体积不变的密闭容器中发生如下反应:
(1)将一定量固体A置于一个容器体积不变的密闭容器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
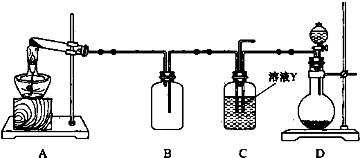
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl固体中含有共价键 | |
| B. | CO2分子中含有离子键 | |
| C. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C是碳的三种核素 | |
| D. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O含有相同的中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液中通入SO2产生白色沉淀,判断Si和S的非金属性强弱 | |
| B. | 比较H2O和H2S还原性强弱,判断O和S的非金属性强弱 | |
| C. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| D. | 铁片投入硫酸铜溶液中,铁片上有紫红色物质生成,判断Fe和Cu的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 铁的 质量g | 铁的 形态 | C(H2SO4) Mol/L | V(H2SO4) m L | 溶液温度 | 金属消失的时间s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 铁片 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 铁片 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 铁粉 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 铁片 | 1.0 | 50 | 20 | 35 | 125 |
| 5 | 0.10 | 铁片 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某些分子中,化学键可能只有π键而没有σ键 | |
| B. | 当原子形成分子时,首先形成σ键,可能形成π键,配位键都是σ键 | |
| C. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| D. | 含有π键的分子在反应时,π键是化学反应的积极参与者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com