
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
分析 (1)据已知热化学方程式,利用盖斯定律计算CO2(g)+H2(g)?CO(g)+H2O(g),可确定化学平衡常数表达式,并确定反应热;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:(1)已知①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,②Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,据盖斯定律,①-②得:CO2(g)+H2(g)?CO(g)+H2O(g)△H=△H1-△H2;反应的K=$\frac{[CO][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]}$,K1=$\frac{c(CO)}{c(C{O}_{2})}$,K2=$\frac{[{H}_{2}]}{[{H}_{2}O]}$,所以K=$\frac{{K}_{1}}{{K}_{2}}$;K1随温度的升高而增大,K2随温度升高而减小,则K随温度升高而增大,说明正反应吸热,
故答案为:△H1-△H2;$\frac{{K}_{1}}{{K}_{2}}$;吸热;
(2)A.反应前后气体体积不变,容器中压强始终不变,故A错误;
B.CO浓度不变,说明各气体浓度都不再变化,反应达到平衡状态,故B正确;
C.v正(H2)=v正(H2O)=v逆(H2O),正逆反应速率相等,但不为0,故C正确;
D.c(CO2)=c(CO)可能是平衡状态,也可能不是,与各物质的初始浓度及转化率有关,故D错误;
故答案为:BC.
点评 本题考查化学平衡影响因素、平衡状态的判断、化学平衡的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目计算量较大,难度较大.


科目:高中化学 来源: 题型:实验题
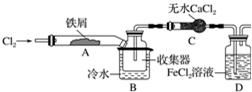 FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
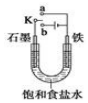 某课外活动小组同学用如图装置进行实验,试回答下列问题
某课外活动小组同学用如图装置进行实验,试回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe (OH )3 溶于稀 H 2 SO4 中:H++OH-→H2O | |
| B. | 氨水滴入 AlCl 3 溶液中:Al3++3OH-→Al(OH)3↓ | |
| C. | FeO 溶于稀 HCl 中:O2-+2H+→H2O | |
| D. | 铝溶解在 NaOH 溶液中:2Al+2OH-+2H2O→2AlO2-+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com