
分析 (1)依据m=CVM计算需要溶质的质量;
(2)依据配制一定物质的量浓度溶液一般步骤选择需要仪器,依据溶解、移液操作过程判断玻璃棒作用;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制物质的量浓度为0.50mol/L的MgCl2溶液100mL,需要溶质氯化镁质量m=0.50mol/L×0.1L×95g/mol=4.8g;
故答案为:4.8g;
(2)用固体配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、量筒、玻璃棒、容量瓶、胶头滴管,用到的玻璃仪器除了烧杯、玻璃棒还有100mL容量瓶、胶头滴管;溶解过程中为了加快固体溶解速率,需要用玻璃棒搅拌,移液操作中需要用玻璃棒进行引流;
故答案为:100mL容量瓶、胶头滴管;搅拌、引流;
(3)a.将烧杯中已溶解的溶液转移后,即加水至刻度线,为进行洗涤操作,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故a选;
b.称量的MgCl2固体中含NaCl杂质,导致称取的固体中含有溶质的物质的量偏小,溶液浓度偏低,故b选;
c.正确定容摇匀后却发现液面下降,属于正常操作,溶质的物质的量和溶液体积都不产生影响,溶液不变,故c不选;
故选:ab.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,明确配制原理及操作步骤是解题关键,注意误差分析的方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
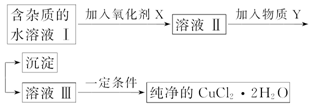
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水分解 | |
| B. | 温度升高,其他溶质的溶解度增大 | |
| C. | 升高温度,降低食盐在水中的溶解度 | |
| D. | 利用阳光、风力蒸发水分使氯化钠成晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
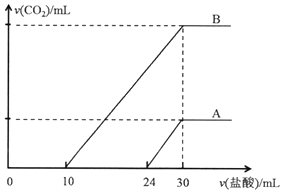 向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.
向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 |
| A | 硅单质 | 制作光导纤维 |
| B | 烧碱 | 治疗胃酸过多 |
| C | 铁罐车 | 常温下用于运输浓硝酸 |
| D | 液氨 | 用作消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
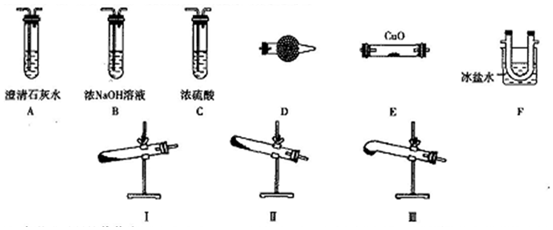
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4LCCl4含有的分子数目为NA | |
| C. | 常温常压下,16g甲烷含有共价键数目为4NA | |
| D. | 1L0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:填空题
已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-2 220 kJ·mol-1
根据上面两个热化学方程式,试回答下列问题:
(1)1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为__________。
(2)现有H2和C3H8的混合气体共5mol,完全燃烧时放热3847kJ,则在混合气体中H2和C3H8的体积比是____________。
(3)已知:H2O(l)=H2O(g) ΔH=44.0kJ·mol-1,试写出丙烷燃烧生成CO2和气态水的热化学方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com