
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 镀锌的铁比镀锡的铁耐用 | |
| C. | 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 | |
| D. | 银制奖牌久置后表面变暗 |
分析 不能用电化学原理解释说明该装置不能构成原电池,只能发生化学腐蚀,根据原电池的构成条件来分析解答,原电池的构成条件是:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护.
解答 解:A.锌、铁和电解质溶液能构成原电池,锌易失电子作负极,铁作正极,所以能用电化学原理解释,故A不选;
B.锌、铁和电解质溶液能构成原电池,锌易失电子被腐蚀,铁作正极被保护,锡、铁和电解质溶液能构成原电池,铁易失电子而作负极,加速被腐蚀,所以镀层被划破后,镀锌的铁制品比镀锡的铁制品耐腐蚀,所以可以用电化学原理解释,故B不选;
C.锌置换出铜,锌、铜和电解质溶液能构成原电池,锌易失电子作负极,铜作正极,所以能用电化学原理解释,故C不选;
D.银质奖牌长期放置后在其奖牌的表面变暗是由于金属银和空气中的成分发生反应生成硫化银的结果,属于化学腐蚀,与电化学腐蚀无关,故D选.
故选D.
点评 本题考查了金属的腐蚀与防护,为高频考点,侧重于学生的分析能力的考查,明确电化学腐蚀与化学腐蚀的区别是解本题关键,再结合原电池构成条件来分析解答,难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 同浓度的下列溶液中:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,c(NH+4)由大到小的顺序是:①>③>② | |
| B. | 常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) | |
| C. | 0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- | |
| B. | 1.Omol•L-1的HNO3溶液:K+、Fe2+、Cl-、SO42- | |
| C. | 1.Omol•L-1 的KI溶液:Na+、Fe3+、Cl-、SO42- | |
| D. | l.Omo•L-1的 CaCl2溶液:Na+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
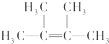 ;名称是2,3-二甲基-2-丁烯.
;名称是2,3-二甲基-2-丁烯.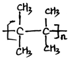 .
.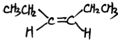 或(CH3CH2)2C=CH2.
或(CH3CH2)2C=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
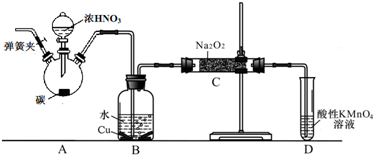
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ(CO)=0.6mol/(L•min) | |
| B. | 4min后,平衡移动的原因可能是向容器中加入了2.0mol的SO2 | |
| C. | 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0mol,则平衡时n(SO2)=0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰熔化时水分子中共价键发生断裂 | |
| B. | 原子晶体中只存在共价键,一定不含有离子键 | |
| C. | 金属晶体的熔沸点均很高 | |
| D. | 分子晶体中一定含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com