
| A. | 钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠 | |
| B. | 铝是地壳里含量最多的金属元素,在常温下,铝不能与氧气反应 | |
| C. | 青铜是我国使用最早的合金,钢是用量最大、用途最广的合金 | |
| D. | 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属 |
分析 A.钠的熔点较低,钠在空气中燃烧生成过氧化钠;
B.铝是地壳里含量最多的金属元素,铝和氧气反应生成一层致密是氧化物薄膜,阻止进一步反应;
C.我国使用最早的合金是青铜,钢是用量最大、用途最广的合金;
D.铁合金易发生电化学腐蚀.
解答 解:A.钠的熔点较低,所以在空气燃烧时先熔化,再燃烧,燃烧时生成淡黄色的Na2O2,故A正确;
B.铝是地壳里含量最多的金属元素,铝是亲氧元素,极易在空气中形成了一薄层致密的氧化膜阻止了铝进一步反应,从而保护内层金属,不是铝不能与氧气反应,故B错误;
C.我国最早使用的合金是由铜、锡形成的青铜,目前世界上用途最广的合金是钢,如炊具、建筑材料等材料,故C正确;
D.铁合金易发生电化学腐蚀,氧化膜疏松,不能保护内层金属,易进一步氧化,应加防护措施,故D正确.
故选B.
点评 本题主要考查了金属的性质方面的知识,掌握钠、铝、合金知识是解答关键,明确铝在空气中不需要特殊保护的原因,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钠与硫酸铜溶液反应会置换出红色的铜 | |
| B. | 常温下干燥氯气与铁不反应,可以用钢瓶储存液氯 | |
| C. | SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 | |
| D. | 普通玻璃的组成可用Na2O•CaO•6SiO2表示,是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
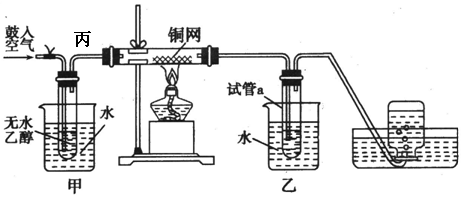
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液中:Na+、HCO3-、NO3-、SiO32- | |
| B. | 某透明溶液中:Fe3+、K+、NO3-、Cl- | |
| C. | 某溶液中加入金属铝有氢气放出:K+、Ba2+、Cl-、SiO32- | |
| D. | 某无色溶液中:K+、Al3+、AlO2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碱 | 盐 | 电解质 | 混合物 | |
| A | 纯碱 | 小苏打 | BaSO4 | 盐酸 |
| B | 烧碱 | 食盐 | NH3•H2O | CuSO4•5H2O |
| C | KOH | CaCO3 | 醋酸 | 水玻璃 |
| D | NH3 | Na2S | 明矾 | 磁性氧化铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照以后,所得混合气体中含有0.07 molHCl | |
| B. | 光照以后,所得混合气体体积小于原混合气体体积(相同条件下) | |
| C. | 最终所得溶液中,NaCl和NaClO的物质的量比为5:2 | |
| D. | 最终所得溶液中,还含有0.02 molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com