
| A. | 氧化剂和还原剂的物质的量之比为1:14 | |
| B. | 由该反应可知还原性:HCl>CrCl3 | |
| C. | 当转移0.2mol电子时,被氧化的还原剂的物质的量为0.2mol | |
| D. | Cl2是该反应的氧化产物 |
分析 某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H20,已知氧化性:K2Cr2O7>Cl2,则K2Cr2O7是氧化剂,Cl2是氧化产物,CrCl3是还原产物,由K元素守恒可知KCl为生成物,根据电子转移守恒可知HCl是反应物,由H元素守恒可知H2O是生成物,发生反应为K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,以此来解答.
解答 解:由信息可知,发生K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,
A.Cr元素的化合价由+6价降低为+3价,Cl元素的化合价由-1价升高为0,由电子守恒可知氧化剂与还原剂的物质的量比为(1-0):2×(6-3)=1:6,故A错误;
B.还原剂的还原性大于还原产物的还原性,则还原性HCl>CrCl3,故B正确;
C.当转移0.2mol电子时,被氧化的还原剂HCl的物质的量为$\frac{0.2mol}{(1-0)}$=0.2mol,故C正确;
D.Cl元素的化合价升高,则Cl2是该反应的氧化产物,故D正确;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| B. | 洗涤沉淀时,应在过滤器中加入洗涤液浸没沉淀,过滤,并重复2到3次 | |
| C. | 抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶支管口倒出 | |
| D. | 用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离KNO3和氯化钠,常用结晶与重结晶 | |
| B. | 分离溴苯和水,常用蒸馏法 | |
| C. | 提纯含有碘的食盐,常用升华法 | |
| D. | 苯和酸性高锰酸钾溶液可用分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+ | |
| B. | 在强碱溶液中:Na+、K+、CO32-、NO3- | |
| C. | 常温下,在pH=12的溶液中:Mg2+、Na+、SO42-、Cl- | |
| D. | 在水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、I-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥②③ | B. | ⑤②③ | C. | ②④⑤ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B
,B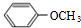 ,C
,C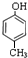 .
. ,②
,②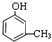 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
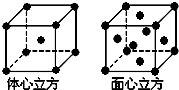 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com