
【题目】有A、B、D、E、F、G六种前四周期的元素,A是宇宙中最丰富的元素,B和D的原子都有1个未成对电子,B+比D少一个电子层,D原子得一个电子填入3p轨道后,3p轨道全充满;E原子的2p轨道中有3个未成对电子, F的最高化合价和最低化合价的代数和为4。R是由B、F两元素形成的离子化合物,其中B+与F2-离子数之比为2∶1。G位于周期表第6纵行且是六种元素中原子序数最大的。请回答下列问题:
(1)D元素的电负性_______F元素的电负性(填“>”、“<”或“=”)。
(2)G的价电子排布图_________________________________。
(3)B形成的晶体堆积方式为________,区分晶体和非晶体最可靠的科学方法是对固体进行_______实验。
(4)D-的最外层共有______种不同运动状态的电子,有___种能量不同的电子。F2D2广泛用于橡胶工业,各原子均满足八电子稳定结构,F2D2中F原子的杂化类型是___________,F2D2是______分子(填“极性”或“非极性”)。
(5)A与E形成的最简单化合物分子空间构型为_____,在水中溶解度很大。该分子是极性分子的原因是_____。
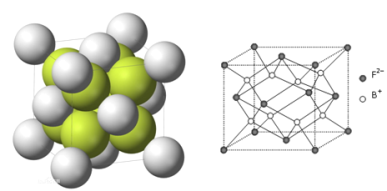
(6)R的晶胞如图所示,设F2-半径为r1 cm,B+半径为r2cm。试计算R晶体的密度为______。(阿伏加德罗常数用NA表示,写表达式,不化简)
【答案】> ![]() 体心立方堆积 X-射线衍射 8 2 sp3 极性 三角锥形 分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性
体心立方堆积 X-射线衍射 8 2 sp3 极性 三角锥形 分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性 
【解析】
A是宇宙中最丰富的元素,说明A为H,D原子得一个电子填入3p轨道后,3p轨道全充满,说明D为17号元素Cl, B和D的原子都有1个未成对电子,B+比D少一个电子层,说明B为Na,E原子的2p轨道中有3个未成对电子,说明E为N,F的最高化合价和最低化合价的代数和为4,说明F为S,G位于周期表第6纵行且是六种元素中原子序数最大的,说明G为Cr,R是由B、F两元素形成的离子化合物,其中B+与F2-离子数之比为2∶1,则R为Na2S,综上,A为H,B为Na,D为Cl,E为N,F为S,G为Cr,据此分析作答。
(1)根据元素周期律可知Cl的电负性大于S;
(2)Cr为24号元素,价电子排布图为![]() ;
;
(3)晶体钠为体心立方堆积,区分晶体和非晶体最可靠的科学方法为对固体进行X-射线衍射实验;
(4)根据核外电子排布规律可知,每个电子的运动状态不同,Cl-最外层有8个电子,所以就有8种不同运动状态的电子,最外层有两个能级,每个能级上电子能量是相同的,所以最外层有2种能量不同的电子,在S2Cl2中要使个原子都满足8电子稳定结构,则分子存在一个S-S键和2个S-Cl键,S原子的价电子数为4,因此S原子以sp3方式杂化,S原子周围有2对孤电子对,所以分子为极性分子;
(5)A与E形成的最简单化合物为NH3,NH3分子中N原子周围有3个共价键,一个孤电子对,因此分子空间构型为三角锥形,由于在NH3中有孤电子对的存在,分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性,所以分子显极性;
(6)R为Na2S,在每个晶胞中含有Na+数为8,S2-为8×![]() +6×
+6×![]() =4,由R的晶胞可设S2-的半径为r1cm,Na+半径为r2cm,则晶胞的体对角线为4(r1+r2)cm,晶胞的边长为
=4,由R的晶胞可设S2-的半径为r1cm,Na+半径为r2cm,则晶胞的体对角线为4(r1+r2)cm,晶胞的边长为![]() (r1+r2)cm,晶体的密度
(r1+r2)cm,晶体的密度![]() =
=![]() =
= g/cm3=
g/cm3=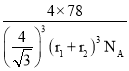 。
。


科目:高中化学 来源: 题型:
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6·SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。
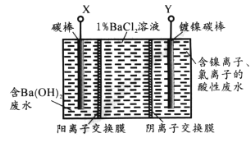
下列分析正确的是
A.X与电池的Li电极相连
B.电解过程中c(BaC12)保持不变
C.该锂离子电池正极反应为:FeS+2Li++2e =Fe +Li2S
D.若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N元素的单质及其化合物之间的转化关系如图所示:NH3←N2→NO→NO2→HNO3
回答下列问题:
(1)N元素在元素周期表中的位置为第___周期,第___族;画出N原子结构示意图___。
(2)工业上用氮气和氢气合成氨气,请写出NH3的电子式___。
(3)实验室可以利用氢氧化钙固体和氯化铵固体制备氨气,请写出该反应的化学反应方程式___;并写出实验室检验氨气的具体操作___。
(4)NO是治疗心血管疾病的信使分子,NO与空气接触的反应现象是___,写出该反应的化学方程式___,若该反应转移0.4mole-,则消耗的NO分子数是___(用NA表示阿伏伽德罗常数)。
(5)浓硝酸具有不稳定性,实验室应该将浓硝酸保存在带玻璃塞的___(填“无色”或“棕色”)试剂瓶中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。
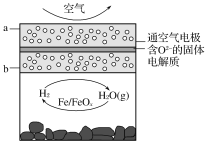
下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:

下列说法不正确的是( )
A. Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. 对比Ⅰ、Ⅲ,推测Na2CO3溶液能破坏铝表面的氧化膜
C. Ⅳ溶液中可能存在大量Al3+
D. 推测出现白色浑浊的可能原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是( )

选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | Pb(NO3)2 |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+D(g),2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
A.前2 min,D的平均反应速率为0.2 mol/(L·min)
B.B的平衡转化率是40%
C.增大该体系的压强,平衡不移动
D.增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
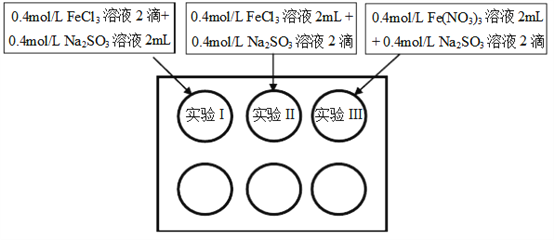
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com