
| A. | 碳原子数≤10 的烷烃,其一氯代物没有同分异构体的烷烃共有3种 | |
| B. | 烯烃、炔烃、芳香烃都能与溴水反应而使其褪色 | |
| C. | 等质量的CH≡CH和C6H6完全燃烧时消耗等物质的量的氧气 | |
| D. | 分子式为C6H12与C3H6的两种烃一定互为同系物 |
分析 A.烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,根据等效氢原子的判断方法分析;
B.芳香烃中若侧链不含碳碳双键或三键,则不能与溴水反应而褪色;
C.乙炔和苯的最简式相同,则质量相同时耗氧量一定相等;
D.C6H12与C3H6可能为烯烃或环烷烃.
解答 解:A.烷烃分子中,同一个碳上的氢原子等效,连在同一个碳原子上的氢原子等效,具有镜面对称的碳原子上的氢原子等效,烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,在碳原子数n≤10的所有烷烃的同分异构体中,其一氯取代物只有一种的烷烃分别是:甲烷、乙烷、2,2-二甲基丙烷以及2,2,3,3-四甲基丁烷,共4种,故A错误;
B.烯烃、炔烃都能与溴水反应而使其褪色,而芳香烃不一定与溴水反应,如苯、甲苯、二甲苯等,故B错误;
C.CH≡CH和C6H6的最简式都是CH,则等质量的CH≡CH和C6H6完全燃烧时消耗等物质的量的氧气,故C正确;
D.C6H12、C3H6可能为烯烃或环烷烃,二者的结构不一定相似,则二者不一定互为同系物,故D错误;
故选C.
点评 本题考查了常见有机物结构与性质,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握同分异构体、同系物的概念及判断方法,试题培养了学生的分析能力及灵活应用能力.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物 | |
| B. | Y和其他四种元素均可形成至少两种的二元化合物 | |
| C. | RY2能与Y、Z形成的一种化合物反应生成Y2 | |
| D. | Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题:
已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题: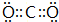 或
或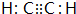 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
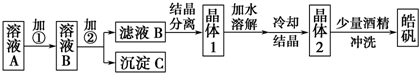
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠可用于制备木材防火剂 | B. | 硅单质广泛用于光纤通讯 | ||
| C. | 硅酸可由二氧化硅与水反应制得 | D. | 水晶项链是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
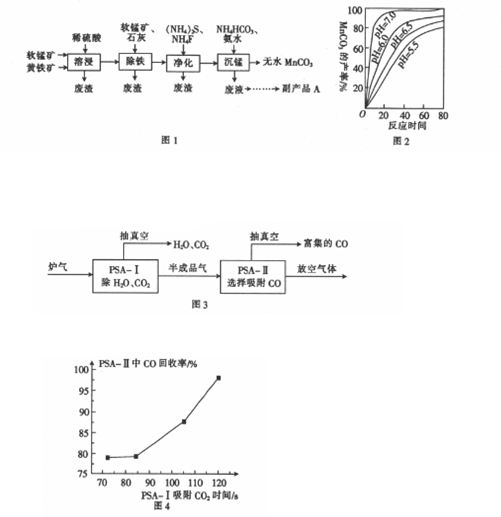
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H2SO40.2mol的浓硫酸与足量的Cu反应可产生SO2分子数为0.1NA | |
| B. | 足量Fe与1 mol氯气反应,转移的电子数为3NA | |
| C. | 标准状况下,22.4LSO3含有分子的数目为NA个 | |
| D. | 1molNa2O2所含离子总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com