
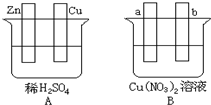
 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:分析 (1)在A图中,使铜片上产生气泡,则该装置应该为原电池,且Cu作正极,Zn作负极,负极上锌生成锌离子,正极上氢离子得电子生成氢气;
(2)在B图中,使a极析出铜,且b极析出气体,该装置应该为电解池,且a为阴极、b为阳极,氢氧根在阳极放电生成氧气;根据电池反应式确定溶液中氢离子浓度变化,根据电池反应式确定溶液中氢离子浓度变化,根据“析出什么加入什么”的原则加入物质.
解答 解:(1)在A图中,使铜片上产生气泡,则该装置应该为原电池,且Cu作正极,Zn作负极,负极电极反应式为Zn-2e-=Zn2+,正极上电极反应式为2H++2e-=H2↑,
故答案为:原电池;Zn-2e-=Zn2+;2H++2e-=H2↑;
(2)在B图中(a,b都为惰性电极),使a极析出铜,电极材料不能得失电子,所以该装置是电解池,a是阴极,阴极上铜离子得电子发生还原反应,电极反应式为:Cu 2++2e-=Cu,b是阳极,阳极上氢氧根离子失电子发生氧化反应,b电极反应式为2H2O-4e-=4H++O2↑,溶液中氢离子浓度增大,溶液的pH降低,根据“析出什么加入什么”的原则加入物质,阴极上析出铜,阳极上析出氧气,要使溶液能恢复原来状态应该加入氧化铜,
故答案为:O2;电解池;Cu 2++2e-=Cu;2H2O-4e-=4H++O2↑;降低;CuO.
点评 本题考查了原电池和电解池原理,根据能否自发进行氧化还原反应确定电池类型,会根据电池反应式确定原电池或电解池电极材料及电解质溶液,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | (A-x+n) mol | B. | (A-x-n) mol | C. | (A-x+n)$\frac{w}{A}$ mol | D. | (A-x-n)$\frac{w}{A}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ①②③ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素的性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为固态,其氢化物的化学式为RH4 |
| Z | 第三周期的简单离子中半径最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2溶液与酸性KMnO4溶液反应:2MnO4-+3H2O2+6H+═2Mn2++6H2O+4O2↑ | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2 NO3-+8H++6I-═3I2+2NO↑+4H2O | |
| C. | 少量SO2通入碳酸钠溶液中:CO32-+SO2═CO2+S O32- | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com