
 按要求完成下列填空:
按要求完成下列填空:分析 (1)根据n=$\frac{m}{M}$计算氧气和臭氧的物质的量之比,结合分子构成计算所含氧原子个数;
(2)根据氯元素守恒结合AgCl的量计算氯离子的物质的量,根据公式m=nM来计算即可;
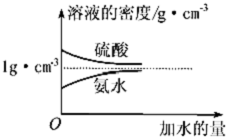
(3)根据稀释定律,稀释前后溶质硫酸的物质的量和质量不变,据此计算稀释后溶液的浓度和质量分数;质量分数为w2的氨水与$\frac{{w}_{2}}{5}$的氨水等质量混合,混合后溶液的浓度小于w2,由图可知,氨水的浓度越大密度越小,据此判断混合后溶液的密度与ρ2 g•cm-3关系.
解答 解:(1)根据n=$\frac{m}{M}$知,等质量的氧气(O2)和臭氧(O3),其物质的量之比等于其摩尔质量的反比=48g/mol:32g/mol=3:2,
一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以所含氧原子的个数之比=(3×2):(2×3)=1:1,
故答案为:3:2;1:1;
(2)金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g即$\frac{86.1g}{143.5g/mol}$=0.6molAgCl白色沉淀,所以氯离子的物质的量是0.6mol,金属氯化物MClx的摩尔质量为133.5g/mol,该金属氯化物质量是26.7g,则$\frac{26.7g}{133.5g/mol}×x=0.6$,解得x=3,所以金属M的摩尔质量为133.5g/mol-(35.5g/mol×3)=27g/mol,故答案为:27g/mol;
(3)令硫酸与水的体积为VL,则混合后溶液的总体积为2VL,根据稀释定律,稀释前后溶质硫酸的物质的量不变,稀释后硫酸溶液的浓度为$\frac{VL×{c}_{1}mol/L}{2VL}$=0.5c1mol/L;质量分数为w1的硫酸与水等体积混合,水的质量小于硫酸溶液的质量,故总质量小于原质量的2倍,故质量分数大于w1/2,
质量分数为w2的氨水与$\frac{{w}_{2}}{5}$的氨水等质量混合,混合后溶液的浓度小于w2,由图可知,氨水的浓度越大密度越小,故混合后溶液的密度大于ρ2 g•cm-3,
故答案为:0.5c1,大于;大于.
点评 本题考查了阿伏伽德罗定律及推论以及溶液中质量分数和物质的量浓度关系之间的换算知识,难度不大,灵活运用公式是解本题的关键,注意基础知识的掌握和积累.


科目:高中化学 来源: 题型:选择题
| 组合分类 | 碱 | 酸 | 纯净物 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | H2SO4 | 冰水混合物 | Na2O2 | SO3 |
| B | NaOH | HCl | 冰醋酸 | Na2O | CO2 |
| C | NaOH | CH3COOH | 烧碱 | CO | SO2 |
| D | KOH | HNO3 | 干冰 | CaO | CO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3可以相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol/L | B. | 0.3 mol/L | C. | 0.2 mol/L | D. | 0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
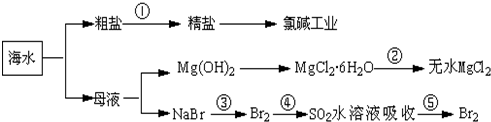
| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程④中SO2被还原 | |
| C. | 从第③步到第⑤步的目的是为了浓缩 | |
| D. | 从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
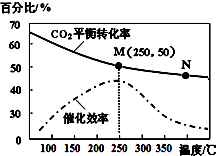 一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )| A. | 该反应的逆反应为吸热反应 | |
| B. | 平衡常数:KM>KN | |
| C. | 生成乙烯的速率:v(N)一定大于v(M) | |
| D. | 当温度高于250℃,升高温度,催化剂的催化效率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40% | B. | 50% | C. | 80% | D. | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
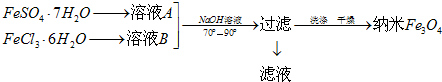
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com