
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是
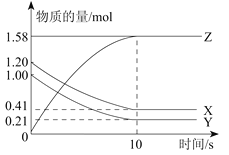
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10 s时,Y的转化率为79.0 %
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】在下列各组物质中,分子数一定相同的是 ( )
A.0.2mol H2和4.48L HCl气体
B.标准状况下1mol O2和22.4L H2O
C.4g 氦气和标准状况下22.4LCO2
D.4L CO和4L CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 氯气溶于水:Cl2+H2O![]() 2H++ClO-+Cl-
2H++ClO-+Cl-
B. 亚硫酸钠溶液被空气中的氧气氧化:SO32-+O2=SO42-
C. 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D. 碳酸氢铵溶液和足量的氢氧化钠溶液混合加热:NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:SO32->I-。某溶液X可能含有NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,为确定其组成,某同学进行如下实验:
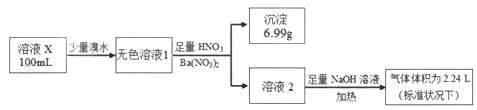
下列说法正确的是
A. 溶液X肯定只存在NH4+、SO42-
B. 溶液X一定不含有Ba2+、Fe3+,可能含有I-
C. 为确定可能存在的阴离子,可另取试液滴加足量盐酸、BaCl2溶液
D. 为确定可能存在的阳离子,可用经过稀硫酸洗过的铂丝蘸取溶液X在酒精灯火焰上灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组用含铬废水制取具有强氧化性的重铬酸钾(K2Cr2O7),实验方案如下:
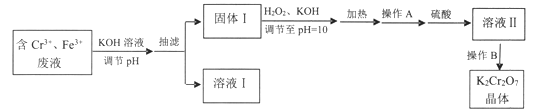
已知:
①Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
②金属离子沉淀的PH如下:
离子 | 开始沉淀的PH | 沉淀完全的PH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 4.1 |
③不同温度下化合物的溶解度如下:
物质 | 溶解度/(g/110g水) | ||
0℃ | 40℃ | 80℃ | |
K2SO4 | 7.4 | 14.8 | 21.4 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
请回答:
(1)操作A的名称是____,加入硫酸的目的是_____。
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式________。
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥。则下列说法正确的是__________。
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可用摩尔盐[(NH4)2SO4·FeSO4·6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作__________。
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如下:
实验序号 | 待测样品溶液的体积/mL | 0.1000mol/L摩尔盐溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 24.98 |
2 | 25.00 | 1.56 | 29.30 |
3 | 25.00 | 1.00 | 26.02 |
则测得K2Cr2O7产品的纯度是_________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
(1)依据题意判断,T ℃________25 ℃(填“大于”、“小于”或“等于”),该温度下水的离子积Kw=__________。
(2)b=__________,原Ba(OH)2稀溶液的物质的量浓度为_____________。
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀量正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
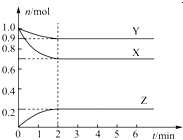
(1)该反应的化学方程式为____________。
(2)反应开始至2min,用气体Z表示的反应速率为____________。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的____________倍;
②若此时将容器的体积缩小为原来的0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习了元素周期律的知识后,同学们设计了多个实验探究元素性质的递变规律。
Ⅰ.甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,选取C、Si、S三种非金属元素的常见化合物,设计了如图装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究。
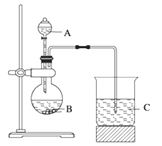
(1)甲组同学设计实验时,A中装H2SO4,则B,C中分别装
B____________________C__________________;
(2)烧杯C中发生反应的离子方程式 ____________________,
(3)通过实验得出的结论:元素非金属性强弱顺序为 ________________。(填元素符号)
Ⅱ.乙组同学认为利用图1装置可直接比较Cl2和S单质的氧化性强弱,他们选择的药品是浓盐酸,KMnO4固体, Na2S溶液。
(4)预计C中观察到的现象是__________________________________________________,
(5)C中反应的离子方程式为_____________________________________________________。
(6)有同学提出该装置存在明显缺陷需加以改进,你认为缺陷是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定的密闭容器内,一定温度下,可逆反应A2(g)+3B2(g)![]() 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
A.容器内每减少1mol A2,同时生成2mol AB3
B.容器内每减少1mol A2,同时生成1mol B2
C.容器内A2、B2、AB3的物质的量之比为1:3:2
D.容器内总压强保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com