
用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO﹣)>c(Na+),对该混合溶液的下列判断正确的是()
A. cCH3COOH)+c(CH3COO﹣)=0.2 mol/L
B. c(OH﹣)>C(H+)
C. c(CH3COOH)>c(CH3COO﹣)
D. c(CH3COO﹣)+c(OH﹣)=0.2 mol/L
考点: 离子浓度大小的比较.
专题: 盐类的水解专题.
分析: A.根据物料守恒判断;
B.从溶液电中性的角度分析;
C.CH3COOH和CH3COONa混合溶液,CH3COOH电离程度大于CH3COO﹣水解程度;
D.根据电荷守恒和醋酸的电离程度分析.
解答: 解:A.n(CH3COOH)+n(CH3COO﹣)=0.2mol,溶液体积为1L,则c(CH3COOH)+c(CH3COO﹣)=0.2mol•L﹣1,故A正确;
B.CH3COOH和CH3COONa混合溶液中,存在c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣),已知c(CH3COO﹣)>c(Na+),则c(H+)>C(OH﹣),故B错误;
C.CH3COOH和CH3COONa混合溶液,CH3COOH电离程度大于CH3COO﹣水解程度,则c(CH3COO﹣)>c(CH3COOH),故C错误;
D.CH3COOH和CH3COONa混合溶液中,存在c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣),醋酸为弱电解质,存在微弱电离,则有0.1mol/L>c(CH3COOH)>c(H+),c(Na+)=0.1mol/L,则c(CH3COO﹣)+c(OH﹣)<0.2mol•L﹣1,故D错误.
故选A.
点评: 本题考查弱电解质和盐类水解问题,题目难度中等,注意根据溶液电中性和物料守恒解答该题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(1)A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期表中的位置如图所示:
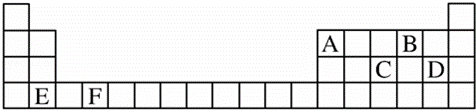
①写出F的基态原子的核外电子排布式:
②C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是 .
(2)A、B、C 3种元素中,A的第一电离能最小,C的电负性最大,3种元素的失电子能力由强到弱的顺序为
.
(3)D、E两种元素形成的化合物化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子,能在溶液中大量共存的是( )
A. Na+、Mg2+、OH﹣ B. H+、SO42﹣、CO32﹣
C. Cu2+、SO42﹣、Cl﹣ D. Ca2+、Cl﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有Cl﹣、SO42﹣、NO3﹣、CO32﹣等阴离子.
(1)当溶液中有大量H+存在时,则上述阴离子在溶液中不可能大量存在的是 .
当溶液中有大量Ba2+存在时,则上述阴离子在溶液中不可能大量存在的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生:一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是()
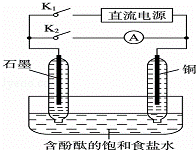
A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl﹣═Cl2↑+H2↑
B. 断开K1,闭合K2时,石墨电极作正极
C. 断开K2,闭合K1时,石墨电极附近溶液变红
D. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e﹣═2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:
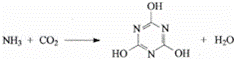
下列有关三聚氰酸的说法正确的是()
A. 分子式为C3H6N303
B. 分子中既含极性键,又含非极性键
C. 属于共价化合物
D. 生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室将NaClO3和Na2SO3按物质的量之比1:2倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为()
A. Cl2 B. Cl2O C. ClO2 D. Cl2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是()
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com