
用导线将铜片和锌片连接后插入稀硫酸中组成原电池,其中铜片作
A.阳极 B.阴极 C.正极 D.负极
科目:高中化学 来源: 题型:
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是( )
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI 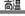 CeI4 + 2H2↑
CeI4 + 2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ == Ce3+ + 2Fe3+
C.金属Ce保存时,应该隔绝空气和水
D.铈的四种核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图.下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________.

(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________.
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O===2NaOH+H2↑).
| 错误观点 | 离子方程式 | |
| ① | 所有的离子方程式均可以表示一类反应 | |
| ② | 所有酸碱中和反应均可表示为:H++OH-===H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组欲测定某品牌味精中氯化钠的含量。该小组的实验步骤如下:
①称取该味精样品10.0g放入烧杯中,并加适量蒸馏水完全溶解;
②加入过量的用硝酸酸化的硝酸银溶液(假定只有NaCl与AgNO3溶液反应)。
③过滤;
④用蒸馏水洗涤沉淀2~3次;
⑤将沉淀烘干、称量,测得其质量为5.74g;
请回答下列问题:
(1)上述实验步骤③操作中所用到的玻璃仪器有 。
(2)若此品牌味精包装袋上标注:“谷氨酸钠含量≥80.0% ,氯化钠含量≤20.0%”;(假设样品中不含其它杂质)。通过上述实验结果,可计算出样品中氯化钠的质量分数为 ,所以该样品 (填“合格”或“不合格”)。
(3)检验上述实验步骤④所得沉淀是否洗净的方法是:取最后一次洗涤液少量,
。
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的两份铝粉分别与等体积的盐酸和NaOH溶液反应,同温同压下产生的气体体积比为1︰1,则盐酸和NaOH溶液的物质的量浓度之比为( )
A.2︰3 B.3︰1 C.1︰2 D.1︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com