
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如图。
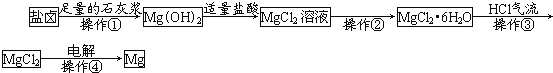
下列说法正确的是( )
A.操作①发生的反应为氧化还原反应
B.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
C.操作②是蒸发浓缩、冷却结晶
D.在整个制备过程中,发生复分解反应、氧化还原反应、分解反应、置换反应
【答案】C
【解析】
盐卤加入足量石灰浆沉淀镁离子生成氢氧化镁沉淀,过滤得到沉淀加入适量盐酸溶解得到氯化镁溶液,通过蒸发浓缩结晶得到氯化镁晶体,在氯化氢气流中失水得到固体氯化镁,电解熔融氯化镁得到金属镁。
A.盐卤和氢氧化钙发生复分解反应生成氢氧化镁,为复分解反应,不是氧化还原反应,故A错误;
B.操作①为过滤操作,滤操作中需要使用漏斗和烧杯、玻璃棒,故B错误;
C.操作②是MgCl2溶液得到MgCl2晶体,需要蒸发浓缩结晶,故C正确;
D.题中涉及反应有氢氧化钙与氯化镁的反应、氯化镁与盐酸的反应以及电解氯化镁,只发生复分解反应、氧化还原反应、分解反应,未发生置换反应,故D错误。
故选:C。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】在工业上可用含SiO2、CeO2和Fe2O3的废料作原料来获得硫酸铁铵晶体(Fe2(SO4)3·2(NH4)2 SO4·3H2O),同时可回收CeO2,工艺流程设计如下
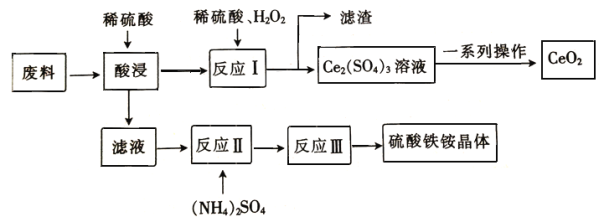
已知: ①SiO2、CeO2不溶于稀硫酸;②酸性条件下,CeO2可与H2O2反应;③“反应Ⅰ”所得溶液中含有Ce3+;④碱性条件下,NH4+与OH-结合生成NH3·H2O。
请回答下列问题
(1)“酸浸”时未发生的反应 物质是__________________(填化学式)。
(2)“滤液”中含有的阳离子有___________________(填离子符号)。
(3)写出“反应Ⅰ”的化学方程式:________________________________________。
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是__________________(填化学式)。
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种实验中常用的仪器
A![]() B
B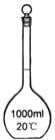 C
C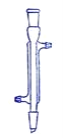 D
D![]()
(1)写出下列代号所代表的仪器的名称:C___________;D___________
(2)分离水和四氯化碳可选用的仪器________ (填仪器代号)。
(3)操作时怎样才能使C仪器中装满所需的水?____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中![]() 键与
键与![]() 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
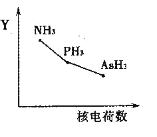
a.稳定性 b.沸点 c.R—H键能 d.分子间作用力
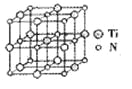
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如图:

操作Ⅱ发生反应的离子方程式为___;如果用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,则生成物中溴的化合价分别为+5和﹣1价,且操作Ⅲ中用稀硫酸代替氯气,请写出这种情况下操作Ⅲ中发生反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷高温裂解的产物有甲烷、乙烷、乙烯、丙烯 4 种气体,当丁烷完全分解时,所得裂解气的平均式量为 ( )
A.58B.43.5C.29D.14.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。请回答下列问题:
(1)NH3、H2O2分子中电负性最大的元素在周期表中的位置为___,第一电离能最大的元素为___。
(2)铬的原子序数为24,其基态电子排布式为___。
(3)1molN2H4分子中含有的σ键数目为___。
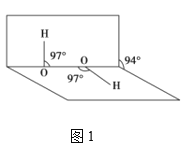
(4)H2O2分子结构如图1,其中心原子杂化轨道类型为___,估计它难溶于CS2,简要说明原因___。
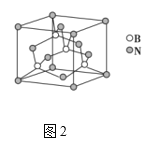
(5)氮化硼晶胞如图2所示,处于晶胞顶点上的原子的配位数为___,若立方氮化硼的密度为ρgcm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为___cm。
(6)如图3所示,若将A离子移到晶胞的体心,则B离子移到了___(填顶点,面心或棱心)。
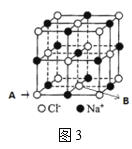
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图的说法不正确的是( )

A. 1mol固态碘与![]() 化合生成2molHI气体时,需要吸收5kJ的能量
化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与![]() 时需要吸收12kJ的能量
时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与![]() 生成HI气体的反应是吸热反应
生成HI气体的反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com