
【题目】半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
![]()
(1)步骤I,CO变换反应的能量变化如下图所示:

①CO变换反应的热化学方程式是________________。
②一定条件下,向体积固定的密闭容器中充入aL半水煤气,发生CO变换反应。测得不同温度(T1,T2)氢气的体积分数ψ(H2)与时间的关系如下所示。
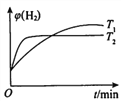
i.T1、T2的大小关系及判断理由是______________。
ii.请在上图中画出:其他条件相同时,起始充入0.5aL半水煤气,T2温度下氢气的体积分数ψ( H2)随时间的变化曲线。______________
(2)步骤Ⅱ,用饱和Na2CO3溶液作吸收剂脱除CO2时,初期无明显现象,后期有固体析出。
①溶液中离子浓度关系正确的是__________(选填字母)。
a.吸收前:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.吸收初期:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)=c(Na+)
c.吸收全进程:c(Na+)+c( H+)=2c(CO32-)+ c(HCO3-)+ c(OH-)
②后期析出固体的成分及析出固体的原因是___________。
③当吸收剂失效时,请写出一种可使其再生的方法(用化学方程式表示):____________。
【答案】 CO(g)+H2O(g)=CO(g)+H2(g) △H=-36kJ/mol T2>T1,相同条件下,温度越高反应速率越快,达到化学平衡状态的时间越短  ac 碳酸氢钠,碳酸氢钠的溶解度比碳酸钠的小,依据反应Na2CO3+CO2+H2O=2NaHCO3,水的质量减小,溶质质量增大 2NaHCO3
ac 碳酸氢钠,碳酸氢钠的溶解度比碳酸钠的小,依据反应Na2CO3+CO2+H2O=2NaHCO3,水的质量减小,溶质质量增大 2NaHCO3![]() Na2CO3+CO2+H2O
Na2CO3+CO2+H2O
【解析】(1)①根据图像可知,CO变换反应的热化学方程式是:CO(g)+H2O(g)=CO(g)+H2(g) △H=-2034 kJ/mol +1998 kJ/mol =-36kJ/mol;
②i.根据图像可知,先拐先平得知T2>T1,即原因为:相同条件下,温度越高反应速率越快,达到化学平衡状态的时间越短;ii.该反应为气体体积不变的反应,根据等效平衡可知,T2温度下,其他条件相同时,起始充入0.5aL半水煤气,为原反应物的一半,平衡时氢气的体积分数不变,浓度为原来的一半,反应速率减小,所需时间更长,故图像为: ;
;
(2)①a、吸收前为饱和Na2CO3溶液,是强碱弱酸盐,水解显碱性且二步水解,但水解是微弱的,故:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),选项a正确;b、吸收前根据物料守恒有:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)=c(Na+),吸收初期碳原子增加,故:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)>c(Na+),选项b错误;c、吸收全进程的离子种类不变,根据电荷守恒都有:c(Na+)+c( H+)=2c(CO32-)+ c(HCO3-)+ c(OH-),选项c正确,答案选ac。②后期析出固体的成分为碳酸氢钠,依据反应Na2CO3+CO2+H2O=2NaHCO3,水的质量减小,溶质质量增大,而溶质碳酸氢钠的溶解度比碳酸钠的小,故析出碳酸氢钠晶体;③当吸收剂失效时,则全部转化为碳酸氢钠,将析出的晶体过滤后灼烧可得碳酸钠,其反应为:2NaHCO3![]() Na2CO3+CO2+H2O。
Na2CO3+CO2+H2O。


科目:高中化学 来源: 题型:
【题目】有机物A-H能发生下图所示一系列变化
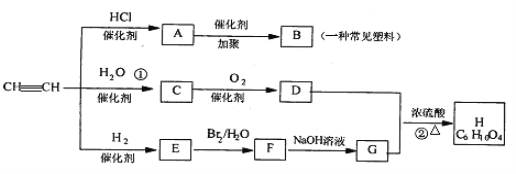
(1)试回答下列:
(1)写出B、G的结构简式:B____________G____________
(2)C 分子中含有的官能团名称是____________,检验该官能团的方法是__________________。
(3)写出化学方程式:
① _________________________________
② _________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是:①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成浅黄色固体物质 ( )
A.①② B.①②③ C.①④⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的的是

实验目的 | ②中的试剂 | |
A | 检验碳与浓硫酸反应产生的气体中含有二氧化碳 | 澄清石灰水 |
B | 用碳酸钙与盐酸反应产生的气体验证碳酸的酸性强于苯酚 | 苯酚钠溶液 |
C | 验证乙醇在浓硫酸作用下发生消去反应产生的气体为不饱和烃 | 酸性高锰酸钾溶液 |
D | 验证石蜡油在碎瓷片上受热分解产生的气体中含有不饱和烃 | 溴的四氯化碳溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于等电子体的说法中,正确的是

A. N2与CO不属于等电子体,故它们的熔沸点、溶解度相差较大
B. PO43-与SO42-不属于等电子体,故结构不相似
C. NO2-与O3属于等电子体,故NO2-为O2的同素异形体
D. 苯与硼氮苯(路易斯结构式如上图)属于等电子体,故硼氮苯中含有大π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:______________。
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4,该元素的名称是____________。
(4)化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O===O:498,则反应P4(白磷)+3O2===P4O6的反应热ΔH为___________________

(5)写出二氧化硫和水合氢离子中S原子,O原子分别采用______和______杂化形式,其空间构型分别为________和__________。
(6)用氢键表示法表示HF水溶液中的所有氢键__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式______________________。
⑵NH2-的电子式为_______________。
⑶N3-有________个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式_____、____。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型___________________。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
(1)乙酸是合成乙酸乙酯的重要原料,制备原理如下:
CH3COOH(l)+ C2H5OH(l)![]() CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
已知:CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78 ℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示:
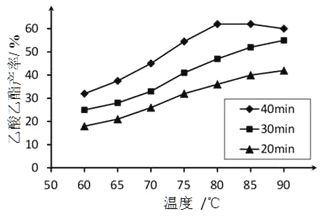
①该研究小组的实验目的是________________。60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
②如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________;
③利用此原理制得的乙酸乙酯粗品中常含有一定量的乙酸、乙醇以及微量的硫酸,提纯时可向粗品中加入__________溶液进行充分洗涤,分离出有机层,并加入无水硫酸钠干燥,最后经过__________、_______两步操作即可得到纯品。
(2)乙二酸俗名草酸(二元弱酸,结构简式:HOOC—COOH),被广泛的应用于抗生素类药物的合成。
①实验室中经常利用酸性KMnO4溶液滴定法测其纯度。已知草酸与酸性KMnO4溶液反应过程有无色无味气体产生,且KMnO4溶液紫色褪去,写出草酸与酸性KMnO4溶液反应的离子方程式_____________________;
②资料表明:25℃时草酸的电离平衡常数Ka1=6.0×10-2;Ka2=6.4×10-5;据此分析,室温时草酸氢钾(KHC2O4)的水解反应平衡常数Kh=________(单位省略,计算结果保留两位有效数字),其溶液中c(H2C2O4)________c(C2O42-)(填“小于”、“等于”或“大于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com