
(12分)盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1 ;H2CO3的电离常数Ka1=4.2×10-7mol·L-1 、 Ka2=5.6×10-11mol·L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因 。
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液
其PH由大到小的顺序是: (填序号)。
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是 ;该醋酸溶液稀释过程中,下列各量一定变小的是 。

a.c(OH-) b.c(H+)
c. d.
d.
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | 氢氧化钠溶液的浓度 (mol·L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 24.12 | 20.00 |
2 | 0.10 | 23. 88 | 20.00 |
3 | 0.10 | 24.00 | 20.00 |
①滴定达到终点的标志是___________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________________。
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw= mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
(1)①HCO3— + H2O 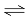 H2CO3 + OH— ②dcab
H2CO3 + OH— ②dcab
(2)b=c>a bd
(3)①滴入最后一滴NaOH溶液,溶液由无色恰好变成浅红色且半分钟内不褪色
②0.12 mol·L-1
(4)①10-13 ②12
【解析】
试题分析: (1)碳酸氢钠中碳酸氢根离子水解程度大于电离程度而导致其溶液呈碱性,碳酸氢根离子水解方程式为:HCO3-+H2O?H2CO3+OH-,②物质的量浓度相同时,碱的pH最大,氢氧化钠是一元碱,氢氧化钡是二元碱,盐溶液中,弱酸越弱,则其酸根离子水解程度越大, CO32-水解程度大于CH3COO-,所以溶液浓度大小顺序是: dcab 答案为:HCO3-+H2O?H2CO3+OH-;dcab;
(2)pH相等的醋酸和盐酸溶液中,加水稀释促进醋酸电离,氯化氢完全电离,所以稀释相同的倍数后,pH变化大的是盐酸,变化小的是醋酸,根据图象知,I是盐酸稀释时的pH变化曲线;
酸抑制水电离,酸的酸性越强,水的电离程度越小,所以溶液体积越大,水的电离程度越大,则水的电离程度由a、b、c三点溶液中水的电离程度由大到小的顺序是b=c>a;
加水稀释醋酸,促进醋酸电离,溶液中除了氢氧根离子、水分子外,所有微粒浓度都减小,
a.温度不变,水的离子积常数不变,c(H+)减小,则c(OH-)增大,错误;
b.溶液中c(H+)减小,正确;
c.温度不变,水的离子积常数不变、醋酸的电离平衡常数不变,可将原式子分子和分母同乘以c(H+)所以
c(CH3COOH)?(OH-)? c(H+) |
c(CH3COO-) ?c(H+) |
不变,错误;
d.加水稀释促进醋酸电离,则氢离子个数增大,醋酸分子个数减小,所以
c(CH3COOH) |
C(H+) |
减小,正确;
故答案为:b=c>a;bd;
(3)①由已知浓度的碱滴定未知浓度的酸,酚酞指示剂在酸溶液中,是无色的,随着碱的量的滴加,酸性减弱,滴入最后一滴NaOH溶液,溶液由无色恰好变成浅红色且半分钟内不褪色,酸碱中和恰好完成。
②碱液的平均体积为V=(24.12 ml +23. 88 ml +24.00 ml)/3=24.00ml c(酸).v(酸)=c(碱)v(碱) c(酸)= 0.10 mol·L-1×24.00 ml /20.00 ml =0.12 mol·L-1
(4)①(1)Kw=c(H+)?c(OH-)=10-a?10-b=10-(a+b)=10-13
②由化学方程式知NaOH+HCl=NaCl+H2O 根据数量关系,反应后余NaOH,c(NaOH)=0.1mol/L,Kw=c(H+)?c(OH_)=10-13 c(H+)=10-12,因此pH=12


科目:高中化学 来源:2014-2015湖南省高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
蛋白质发生的下列过程中,可逆的是
A.盐析 B.变性 C.煮熟 D.加入浓硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省郴州市高一上学期期中考试化学试卷(解析版) 题型:填空题
按要求完成下列化学用语:
(1)NaHSO4的电离方程式: ,
(2)CuSO4溶液和NaOH溶液反应的离子方程式: ,
(3)能用H++OH-=H2O表示的一个化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省郴州市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列关于容量瓶及其使用方法的叙述,正确的是
A.是配制一定物质的量浓度的溶液的专用仪器
B.容量瓶可以用来加热
C.能用容量瓶贮存配制好的溶液
D.可以用500mL容量瓶配制250mL溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市四校高二12月联考化学试卷(解析版) 题型:选择题
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:
A.充电时阳极反应:Ni(OH)2 -e- + OH- =NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH- 向正极移动
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市四校高二12月联考化学试卷(解析版) 题型:选择题
对于可逆反应:mA(g)+nB(g) xC(g)+ yD(s) ΔH=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是
xC(g)+ yD(s) ΔH=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是

A.ΔH>0,m+n>x+y B.ΔH<0,m+n>x+y
C.ΔH<0,m+n>x D.ΔH>0,m+n<x
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省许昌市四校高一上学期第三次联考化学试卷(解析版) 题型:选择题
下列有关溶液的说法正确的是
A.将质量分数为40%(密度为1.43 g·cm-3)的NaOH溶液与等体积水混合,所得溶液中溶质的质量分数是20%
B.要配制浓度为0.25 mol·L-1的NaOH溶液480 mL,应称量4.8 g NaOH在250 mL的烧杯中溶解,冷却,再转移到500 mL容量瓶中,洗涤、转移、定容
C.配制一定物质的量浓度的溶液,定容时俯视刻度线导致所配浓度偏高
D.配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列溶液中有关物质的量浓度关系正确的是
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)
B.pH相等的CH3COONa和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)=c(A-)
D.0.1 mol·L-1的 NaHA 溶液pH=1则有c(Na+)=c(H2A)+c(HA-)+c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com