
 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
分析 (1)根据常用仪器的名称解答;根据C、D两根温度计在实验装置中的位置确定其作用;
(2)溴乙烷沸点低、极易挥发,冰水浴的目的是降低其蒸气的温度,使其液化;溴能与亚硫酸氢钠反应,而溴乙烷与亚硫酸氢钠不反应;
(3)浓硫酸具有吸水性、脱水性、强氧化性,乙醇易被氧化,溴化氢易挥发,据此分析解答;
(4)互不相溶的液体用分液的方法进行分离,根据图表可知,浓硫酸的密度大于溴乙烷;
(5)先根据7.725g溴化钠计算出生成的n(溴乙烷),然后根据m=nM计算理论质量,最后根据转化率的概念来解答.
解答 解:(1)仪器E为冷凝管,反应装置中C温度计的水银球的位置位于三颈烧瓶中支管口的正中央,测量的是蒸汽的温度,D温度计用来测反应体系的温度,便于控制反应温度;故答案为:冷凝管;D温度计用来测反应体系的温度;
(2)溴乙烷沸点为38.2℃,沸点低、极易挥发,冰水浴的目的是降低其蒸气的温度,使其液化,可以防止溴乙烷的挥发,浓硫酸具有强氧化性,能氧化溴化氢生成溴单质,2HBr+H2SO4(浓)=Br2+SO2↑+2H2O,溴能与亚硫酸氢钠反应,而溴乙烷与亚硫酸氢钠不反应,在接受器F中加冷水及3mL饱和亚硫酸氢钠溶液,作用为除去反应中的副产物溴,
故答案为:溴乙烷沸点低、极易挥发,冰水主要可以防止溴乙烷的挥发;除去反应中的副产物溴;
(3)a.浓硫酸具有脱水性,乙醇含有碳、氢氧三种元素,可被浓硫酸脱水,缓缓加入可以防止乙醇发生碳化,故a正确;
b.缓缓加入浓硫酸,可控制反应速率,避免生成HBr的速度过快,减少其挥发,故b正确;
c.浓硫酸溶于水放热,但放出的热量不能使该混合溶液暴沸,故c错误;
d.浓硫酸具有强氧化性,能氧化溴化氢生成溴单质,缓缓滴入,能减少因浓硫酸氧化HBr而生成副产物溴,故d正确;
故答案为:abd;
(4)步骤③中分出馏出液中有机层为溴乙烷,溴乙烷不溶于水,可用分液的方法进行分离,浓硫酸(H2SO4)密度1.84g•cm-3,溴乙烷密度1.46g•cm-3,浓硫酸的密度大于溴乙烷,加入浓硫酸除杂后的溶液明显分层,上层为溴乙烷,下层为浓硫酸,
故答案为:分液;上;
(5)NaBr+H2SO4→HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O,1mol溴化钠可生成1mol溴乙烷,7.725g溴化钠的物质的量为n=$\frac{7.725g}{103g/mol}$=0.075mol,生成溴乙烷的质量为0.075mol×109g/mol=8.175g,收集35-40℃的馏分,称量得5.23g,则产率为:$\frac{5.23g}{8.175g}$×100%=64%,
故答案为:64%.
点评 本题考查有机物制备实验,涉及实验室HBr的制备、物质的分离提纯、对操作与原理的分析评价等,综合考查学生实验分析的能力、知识迁移运用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | HCl溶液中无OH- | |
| B. | NaOH溶液中无H+ | |
| C. | NaCl溶液中既无OH-也无H+ | |
| D. | 常温下,任何物质的水溶液中都有H+和OH-,且KW=c(H+)•c(OH-)=10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
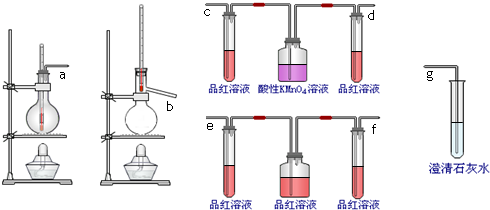
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
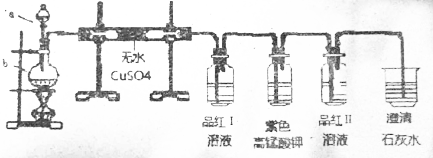
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
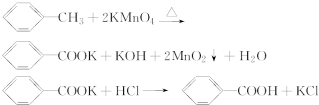
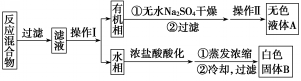
| 序号 | 实验方案 | 实验现象 | 结果 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | |
| B. | 平衡向逆反应方向移动 | |
| C. | 平衡不移动,但容器内的压强将增大 | |
| D. | 平衡不移动,且容器内的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com