

A.离子半径:K+>Cl->Na+>F- |
| B.酸性:H2SO4>H3PO4>H2CO3>H2SiO3 |
C.熔点:石英>食盐>钾>干冰 |
D. 还原性:NaCl>NaBr>NaI>Na2S 还原性:NaCl>NaBr>NaI>Na2S |
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Na+、Fe3+、Cl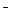 、SCN 、SCN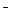 能大量共存于同一溶液中 能大量共存于同一溶液中 |
B.碳酸氢钠溶液与足量的氢氧化钡溶液混合后,其离子方程式为:HCO3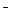 + Ba2+ + OH + Ba2+ + OH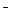 ="=" BaCO3↓+H2O ="=" BaCO3↓+H2O |
C.若R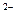 和M+的电子层结构相同,则原子序数的比较为:R>M 和M+的电子层结构相同,则原子序数的比较为:R>M |
D.若X原子中的质子数为a,中子数为b,则X的质量数为: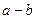 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 甲判断 | 乙判断 |
| A | 某化合物溶于水能导电 | 该化合物是电解质 |
| B | 某过程发生能量变化 | 该过程发生化学反应 |
| C | 钠原子核外电子数比铝少 | 钠的金属性比铝强 |
| D | 两种元素同一主族 | 两种元素的原子最外层电子数相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X、Y、W的最高价含氧酸酸性顺序:Y>W>X |
| B.Z、W可形成ZW2的化合物,属于离子化合物 |
| C.离子半径:Z>W>Y |
| D.气态氢化物的稳定性:Z>W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1H2O与2H2O为两种不同核素 |
| B.3He和4He互为同位素 |
| C.核聚变时,原子核发生了变化,发生了化学反应 |
| D.在3He中存在:质子数=中子数=核外电子数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
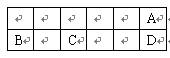
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com